Вектор (англ. vector) – это «переносчик инфекции». Данное понятие применяется в разнообразных случаях. Примеры векторов из разных областей биологии:
1) кровососущие насекомые выступают как векторы патогенных микроорганизмов и вирусов, вызывающих болезни позвоночных животных;
2) насекомое из рода Sire.х – это вектор, переносящий пропагулы базидианального гриба Aniylostereum, вызывающего гниль ствола хвойных деревьев.
Молекулярный вектор – это молекула ДНК, в которую возможна встройка фрагмента чужеродной ДНК. Она способна переносить данный фрагмент в своем составе в реципиентные клетки, самостоятельно реплицироваться и стабильно поддерживаться в реципиентных клетках, либо встраиваться в геном хозяина и также стабильно в нем поддерживаться.
По другому определению, молекулярные векторы – это гибридные молекулы ДНК, несущие искусственно встроенный фрагмент, представляющий тот или иной интерес, и способные амплифицироваться (размножаться) в живых клетках отдельно от основного генома хозяина или встраиваться в него.
- Общие представления о нуклеиновых кислотах
- Функции и главнейшие типы векторов
- Назначение векторов:
- Главнейшие типы векторов (по назначению):
- Молекулярный вектор должен обладать:
- Необходимые свойства клонирующих векторов:
- Лентивирусные векторы: как они стали лучшими векторами для терапии ex vivo
- Лентивирусные векторы: как они стали лучшими векторами для терапии ex vivo
- Генная и клеточная терапии
- In vivo vs Ex vivo
- Лентивирусы в природе: что они собой представляют?
- Строение
- Жизненный цикл лентивирусов
- Создание лентивирусных векторов
- Безопасность превыше всего
- Рекомбинация
- Инсерционный мутагенез
- Три поколения векторов
- Производство
- Альтернатива: стабильные упаковщики
- Применение лентивирусных векторов в клинике
- Заключение и перспективы
- Генная инженерия для биотехнологических производств
- 🎥 Видео
Видео:Введение в генную инженерию (видео 1) | Генная инженерия |Молекулярная генетикаСкачать

Общие представления о нуклеиновых кислотах
ДНК – это биологический гетерополимер. В обычном состоянии первичная структура ДНК представляет собой двойную спираль, состоящую из двух длинных полимеров, закрученных вокруг обшей оси. Ширина спирали составляет 2-2,6 нм. Две цепи ДНК, образующие спираль, по своей химической структуре являются антипараллельными, т.е. ориентированы в противоположные стороны. В живой клетке спираль образует компактизированную структуру, в которой ДНК намотана на хроматиновые белки или гистоны. Остов ДНК образован сахарофосфатными группами, соединенными сложноэфирными связями. Сахарид, входящий в состав ДНК, является пентозой, т.е. 5-углеродным сахаром.
Единицы или мономеры ДНК – это нуклеотиды.
Основание, соединенное с сахаридом, образует нуклеозид, а нуклеозид, соединенный с остатком фосфорной кислоты в позиции пентозного кольца 5’, образует нуклеотид.
В результате репликации образуется две идентичные копии двойной спирализированной молекулы ДНК.
Конец молекулы, на котором имеется свободная гидроксильная группа, находящаяся в позиции 3’ пентозного кольца, называется три-штрих, или три-прим концом. Противоположный конец, на котором имеется остаток фосфорной кислоты, присоединенный к углеродному атому 5’ дезоксирибозы, называется пять-штрих, или пять-прим концом.
В рибонуклеиновой кислоте (РНК) в остов молекулы входит сахарид рибоза, у которого, в отличие от дезоксирибозы, в позиции 2’ пентозного кольца имеется гидроксильная группировка.
Основания в составе ДНК делятся на пурины и пиримидины. Пуриновые основания имеют 2 кольца, состоящие из атомов C и N, а пиримидины – одно кольцо. К пуринам принадлежат аденин и гуанин, к пиримидинам – цитозин и тимин, а также уроцил, который заменяет тимин в РНК.
Метилирование – это способ модификации нуклеотидов в живых системах. НДНК «схлопываются» подобно застежке-молнии. Матричные процессы и центральная догма молекулярной биологии Центральная догма молекулярной биологии описывает путь передачи генетической информации в клетке по генеральной схеме ДНК / матричная ГНК / белок. Матричная РНК (мРНК) называется еще мессенджер-PHК. Главныаиболее распространенный пример метилирования – это 5-метилцитозин. В двойной молекуле ДНК нуклеотиды образуют комплиментарные (взаимодополняющие) пары пурины-пиримидины, объединенные водородными связями. Между А и Т образуется 2 водородные связи, между G и С – 3. По этой причине пары G-С связаны более прочно.
В векторных системах ДНК используется как в одноцепочечной , так и двухцепочечной форме. Одна из цепей, кодирующая белок, называется смысловой, а комплиментарная ей – антисмысловой.
При температуре 90-95 градусов водородные связи между нитями ДНК рвутся, и двунитевая ДНК разделяется на две однонитевые молекулы. Этот процесс называется денатурацией, или плавлением. Если молекулы находятся в растворе, то при понижении температуры они ассоциируются вновь, благодаря комплиментарным взаимодействиям между нуклеотидами. Этот процесс называют гибридизацией. При этом нити ДНК «схлопываются» подобно застежке-молнии. Матричные процессы и центральная догма молекулярной биологии Центральная догма молекулярной биологии описывает путь передачи генетической информации в клетке по генеральной схеме ДНК / матричная ГНК / белок.
Матричная РНК (мРНК) называется еще мессенджер-PHК.
Главными путями передачи генетической информации являются:
— ДНК — ДНК (репликация ДНК);
— ДНК > мРНК (транскрипция у прокариот);
— ДНК — пре-мРНК — зрелая мРНК (транскрипция и созревание РНК );
— мРНК — белок (трансляция).
Специальные пути передачи информации:
— мРНК — ДНК (обратная транскрипция, для РНК-содержащих вирусов или ретровирусов);
— РНК — РНК (репликация РНК).
Репликация ДНК у про- и эукариот идет с помощью набора специальных ферментов. Главнейшие из них – ДНК-полимеразы, которые достраивают комплиментарную цепь на основе одноцепочечной молекулы, используя свободные мононуклеотиды в качестве строительных блоков.
Транскрипция происходит с участием фермента транскриптазы. Транскрипция и созревание мРНК у эукариот происходят в клеточном ядре, в частности на молекулярных машинах биосинтеза белка – рибосомах.
Экспрессия гена – это процесс, при котором заложенная в гене информация используется для синтеза функционального продукта. Функциональным продуктом может являться:
2) рибосомальная РНК;
3) тринспортная РНК;
4) малая ядерная РНК.
Последний из видов РНК принимает участие в сплайсинге и в процессе формирования рРНК. В случае применения векторов наибольший практический интерес представляет экспрессия белок-кодирующего гена.
Видео:Возможности генной инженерии | Лекции по биологии – биолог Александр Панчин | НаучпопСкачать

Функции и главнейшие типы векторов
Предпосылки разработки и применения молекулярных векторов в генной инженерии и биотехнологии.
1. Открытие нуклеиновых кислот и генетического кода;
2. Открытие внехромосомных элементов у про- и эукариот – плазмид;
3. Открытие вирусов и в особенности механизмов встраивания вирусной ДНК в геном хозяина;
4. Разработка методов выделения высокоочищенных препаратов неповрежденных плазмид и неповрежденной ДНК вирусов;
5. Раскрытие механизмов проникновения чужеродной ДНК в клетки;
6. Открытие ферментов, обеспечивающих репликацию и модификацию ДНК.
Видео:Генная инженерия. Изменит все и навсегда.Скачать

Назначение векторов:
В фундаментальной науке векторы служат для изучения отдельных генов и целых геномов путем их клонирования и последующего сиквенса, для изучения функций генов и молекулярных механизмов их экспрессии. В инженерии векторы используются с целью создания генно-модифицированных организмов продуцентов.
Видео:Клонирование ДНК и рекомбинантная ДНК (видео 4) | Генная инженерия | Молекулярная генетикаСкачать

Главнейшие типы векторов (по назначению):
- Клонирующие векторы – служат для наработки большого количества копий встроенного фрагмента ДНК (например, с целью его последующего сиквенса – расшифровки последовательности);
- Экспрессирующие векторы – служат для получения чужеродного белка в организме-хозяине (организме-продуценте); векторы, обеспечивающие правильную и эффективную экспрессию чужеродных генов в клетках. Встроенный в вектор ген не только амплифицируется, но на его основе происходит образование мРНК и затем белков. Экспрессирующие векторы используются для создания штаммов микроорганизмов, продуцирующих чужеродный белок в повышенных количествах.
- Нацеленные векторы – служат для введения дефектного гена в геном изучаемого oрганизмa с целью выявления фенотипического проявления генов. Вектор, используемый для инактивации какого-либо гена при генетических исследованиях определенных организмов, называют нацеленным.
По поведению относительно генома хозяина векторы делят на интегративные и неинтегративные. Если вектор обеспечивает встройку чужеродной ДНК в геном клетки, то он называется интегративным.
Видео:Просто о генной инженерииСкачать

Молекулярный вектор должен обладать:
1) участком, определяющим начало репликации;
2) сайтом для встройки чужеродной ДНК;
3) селективным маркером.
Видео:Максим Казарновский: "Генная инженерия"Скачать

Необходимые свойства клонирующих векторов:
1) вектор должен нести нуклеотидную последовательность, которая отвечает за автономную репликацию данной молекулы в определенном типе клеток;
2) не должен терять репликативных свойств даже при встройке чужеродного фрагмента ДНК;
3) должен иметь как можно малое число мест расщепления определенной рестриктазой, лучше один сайт или локус рестрикции;
4) должен содержать 1 или несколько генетических маркеров, по которому может быть произведен отбор клоном, т.е. если вектор успешно внедрился в клетку, эту клетку необходимо отобрать по хорошо различимому признаку и размножить, а затем произвести молекулярное клонирование;
5) должен реплицироваться с образованием повышенного числа копий в клетке.
Видео:ПРОТИВОестественный отбор | ALIСкачать

Лентивирусные векторы: как они стали лучшими векторами для терапии ex vivo
22 октября 2021
Видео:19 20 Базовые методы генной инженерииСкачать
Лентивирусные векторы: как они стали лучшими векторами для терапии ex vivo
- 992
- 0,0
- 0
- 6
Иногда самый безопасный и эффективный вариант генной терапии — не вводить вектор непосредственно пациенту, а наоборот, выделить клетки пациента, произвести с ними генно-инженерные манипуляции и ввести обратно ему же. В таком случае непревзойденный инструмент — лентивирусные векторы. Рисунок в полном размере.
Автор
Редакторы
Возникшая в конце XX века пандемия ВИЧ-инфекции и сопутствующее распространение синдрома приобретенного иммунодефицита (СПИДа) послужили толчком к масштабным исследованиям вызывающего эти патологии вируса. В этих исследованиях раскрыли детали организации генома, репликации и жизненного цикла вируса иммунодефицита человека 1, проложив тем самым путь для создания на его основе лентивирусных векторных систем. Такие системы использовались в создании самой первой одобренной CAR-T-терапии — лечения, подарившего надежду безнадежным больным, и ставшего одним из самых громких прорывов в онкогематологии за последние годы. А помогли тут во многом некоторые уникальные свойства лентивирусов, которые, как выяснилось, могут нести не только смерть, но и жизнь.
Видео:ГМО-люди. Опыты уже начались?Скачать

Генная и клеточная терапии
Спецпроект о генной и клеточной терапиях, тернистом пути их развития, первых успехах и надеждах, а также о сложностях регулирования, производства и изучения этих новейших методов лечения.
Партнер спецпроекта — Департамент разработки генотерапевтических препаратов одной из крупнейших российских биотехнологических компаний — BIOCAD. BIOCAD заслужил серьезные позиции на мировом фармацевтическом рынке благодаря выпуску лекарственных препаратов на основе антител.
Со времени зарождения генной терапии — начиная с самых первых исследований и клинических испытаний — дорога к ее широкому внедрению была тернистой. Впечатляющие успехи чередовались с досадными провалами, отбросившими на новое лечение порочащую тень, что в какой-то момент резко затормозило развитие области [1].
Вы читаете пятую статью спецпроекта «Генная и клеточная терапии». Ранее мы уже информировали вас, как вообще устроены лекарства будущего [2], а также достаточно подробно останавливались на аденоассоциированных вирусах [3] как важном инструменте «генных терапевтов».
К счастью, сегодня все уже не так драматично: генная терапия стала намного безопаснее — регуляторный надзор за ней усилился, а критерии контроля качества стали строже. И все же, бросая даже беглый взгляд на ландшафт современных видов генного лечения, осознаешь, что путь в клинику для большинства таких лекарств до сих пор крайне непрост. Достаточно сравнить число запускаемых клинических исследований с количеством уже вышедших на рынок терапий — последних несоизмеримо меньше. Причин этому немало: это и вопросы безопасности и эффективности; и сложность разработки и масштабирования производства; и вопросы экономической и практической обоснованности внедрения этих совсем недешевых терапий .
Подробнее о тернистом пути разработки и производства генного лечения читайте в статье: «Генные и клеточные лекарства: сложное регулирование для сложных продуктов» [4]; ну а об экономических перипетиях при внедрении сверхдорогих инновационных лекарств (да и не только их) расскажет статья: «Фармакоэкономика: лечить или экономить?» [5].
Однако генная терапия по-прежнему более чем актуальна, ведь она предлагает регулирование молекулярных процессов на новом уровне, тем самым позволяя подбирать ключи к лечению ранее неприступных болезней.
Существующие ныне генные терапии в основном работают по принципу внедрения нужного генетического материала в определенные клетки пациента, что и позволяет модулировать происходящее в организме с лечебными целями. Поэтому для такого лечения критически важна успешная доставка требуемого гена в целевые клетки и ткани, что чаще всего осуществляют с использованием особых носителей — векторов.
Видео:Биотехнология, ее направления. Клеточная и генная инженерия | Cериал CЕЛЕКЦ EDUCATION | ВебиумСкачать

In vivo vs Ex vivo
В предыдущих статьях нашего цикла о генной терапии уже были довольно подробно разобраны имеющиеся ныне решения. Не будем сильно повторяться, но отметим особо важные для дальнейшего повествования моменты.
- Обозревая генную терапию, в основном имеет смысл говорить о доставке генов c применением вирусных векторов, — другие способы пока используют гораздо реже.
- В рамках такого лечения реализуют два совсем разных подхода: in vivo и ex vivo. Это во многом и определяет выбор подходящих векторов для доставки генов.
Терапия in vivo — это прямой перенос векторов в организм пациента путем внутривенной инфузии раствора, содержащего такие носители. В такой доставке наилучшим образом проявили себя аденоассоциированные векторы, поскольку имеют широкий тропизм — специфичность к различным типам клеток, а также низкий уровень генотоксичности и соответственно бóльшую безопасность [3].
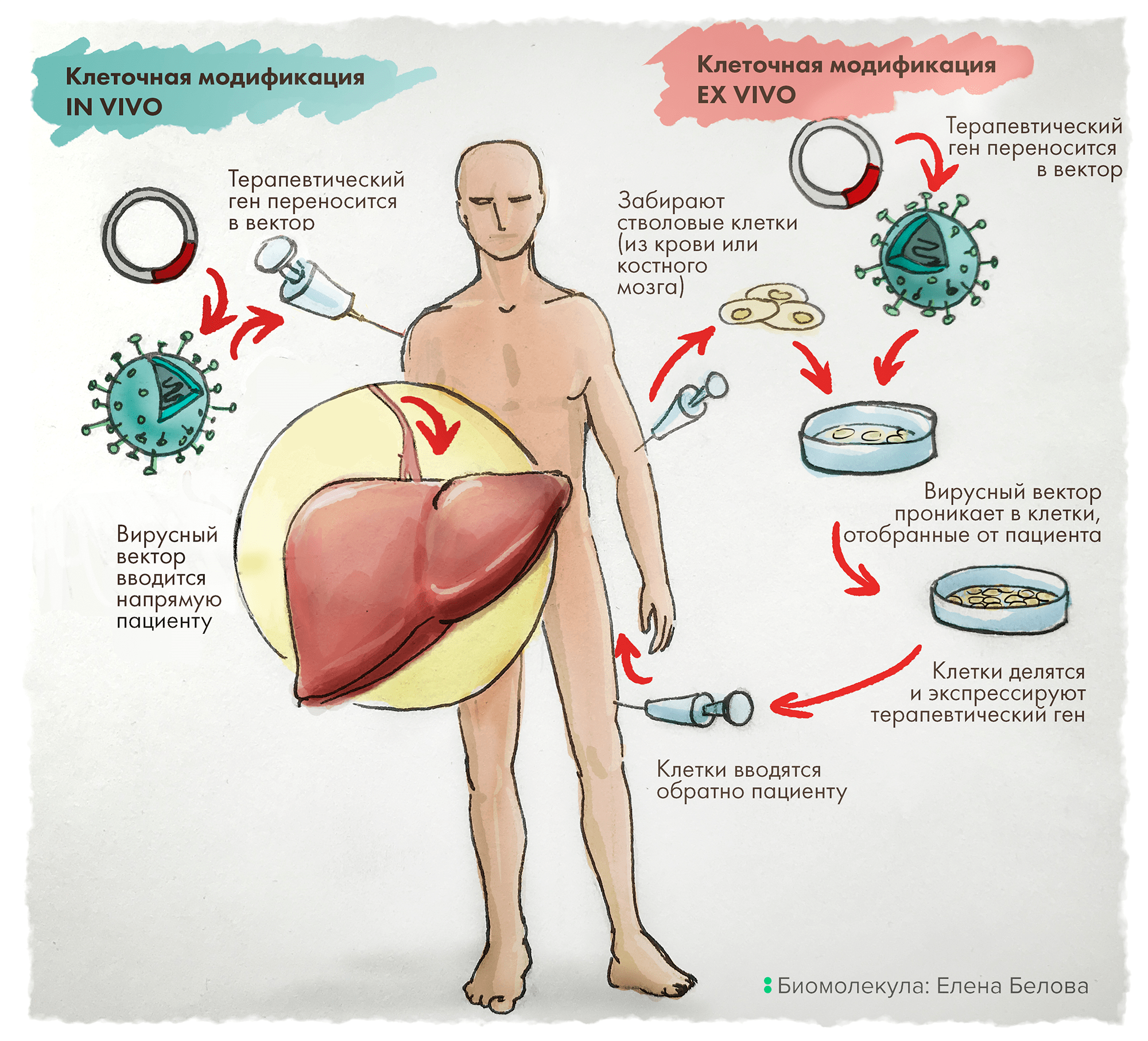
Альтернативно терапевтический ген может быть доставлен ex vivo: для этого клетки сначала отбирают у пациента, генетически модифицируют и культивируют вне организма. И только после этого такие несущие целевые (читай — терапевтические) гены клетки вводят путем инфузии обратно пациенту (рис. 1) [6].
Рисунок 1. In vivo vs Ex vivo. Терапия in vivo заключается в прямой доставке в организм пациента векторов, содержащих терапевтические гены. В отличие от этого, подход ex vivo включает предварительный отбор клеток у пациента, их генетическую модификацию in vitro (это, как правило, внедрение нужного — лечебного — гена), затем отбор эффективно трансдуцированных клеток с последующим размножением и введением такой культуры клеток обратно пациенту.
Для клинических приложений терапии ex vivo изначально были особо интересны γ-ретровирусы и лентивирусы, — ведь они способны перманентно интегрировать свой генетический материал в геном клеток организма-хозяина, что подразумевает передачу генов интереса при делении в ряду клеточных поколений, а значит, низкую элиминацию и долгоиграющую экспрессию.
Однако по сравнению с γ-ретровирусными векторами лентивирусы оказались безопаснее в доклинических исследованиях, а потому сейчас преимущественно используются именно они [7]. Лентивирусные векторы способны еще и трансдуцировать как постмитотические, так и неделящиеся клетки, в то время как для эффективного инфицирования с использованием других ретровирусных платформ требуется, чтобы клетка активно делилась [6]. Дело в том, что среди всех ретровирусов только лентивирусы способны проникать через ядерную мембрану.
Серьезными плюсами лентивирусных векторов являются также относительно низкая стоимость и возможность масштабирования производства. Эта платформа была выбрана для создания одной из наиболее многообещающих ныне генных терапий ex vivo: онколечения с использованием CAR-T-клеток [8], — и используется сегодня при разработке таких препаратов наряду с γ-ретровирусами. К этому мы еще вернемся.
Видео:Тайны сознания. Бог в нейронах - [ Теория Всего от Athene ]Скачать
![Тайны сознания. Бог в нейронах - [ Теория Всего от Athene ]](https://i.ytimg.com/vi/BY9v5jOr4BY/0.jpg)
Лентивирусы в природе: что они собой представляют?
Строение
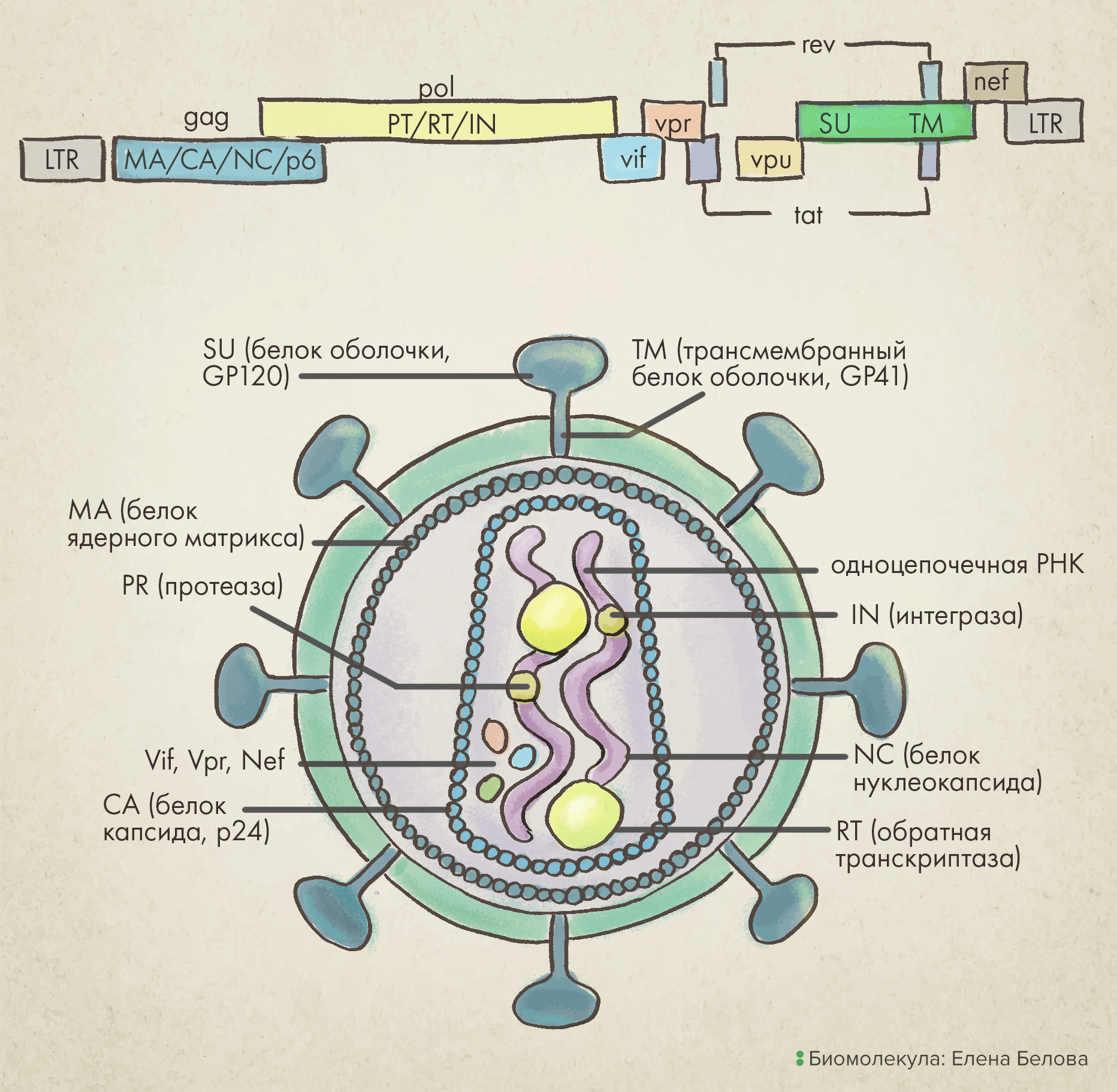
Род лентивирусов из семейства ретровирусов отличается наличием особой оболочки (суперкапсида), внутри которой заключен геном в виде положительной одноцепочечной РНК , которая после попадания вируса в клетку конвертируется в двухцепочечную ДНК. Наиболее известный их представитель — вирус иммунодефицита человека (ВИЧ) [9]. Покрывающий такие вирусы суперкапсид — сферический, слегка плеоморфный, диаметром приблизительно 80–100 нанометров. Длина его генома около 9 килобаз (тысяч пар нуклеотидных оснований), включая три основных структурных гена: gag, pol и env (рис. 2).
Под положительной (+) РНК понимают геномную нуклеиновую кислоту вируса, похожую на мРНК, благодаря чему информация в ходе трансляции — синтеза полипептидной цепи вирусного белка в зараженной клетке — может считываться непосредственно с нее. Такую (+)РНК называют также смысловой. В отличие от этого, антисмысловая (−) РНК комплементарна мРНК, и для перевода в аминокислотную цепочку ее требуется сначала реплицировать в (+)-форму с помощью фермента РНК-репликазы.
Рисунок 2. Лентивирус: геномная карта и структура вириона. Важный для проникновения в клетку ген env обозначен зеленым цветом.
Ген gag первым транскрибируется в незрелую пре-мРНК, которая затем расщепляется на отдельные транскрипты, кодирующие три белка вирусного кора:
- Матричный белок (matrix, MA) необходим для сборки вириона и инфекции неделящихся клеток.
- Капсидный белок (capsid, CA) формирует гидрофобную «сердцевину» вириона.
- Нуклеокапсидный белок (nucleocapsid, NC) накрепко связан с РНК в вирионе — он механически «укрывает» последовательность нуклеотидов, защищая тем самым вирусный геном.
Ген pol кодирует ферменты, необходимые для репликации генетического материала: вирусную протеазу (PRO), обратную транскриптазу (RT) и интегразу (IN).
Наконец, ген env кодирует белок вирусной поверхности: гликопротеин gp160, который в процессе созревания вирусной частицы расщепляется на белок поверхности вириона gp120 (SU) и трансмембранный белок gp41 (TM).
Кроме того, вирусный геном содержит регуляторные гены (tat и rev), которые после инфицирования вирионом экспрессируются первыми и нужны для ускорения продукции мРНК, а также четыре вспомогательных гена (vif, vpr, vpu, и nef) [10].
Жизненный цикл лентивирусов
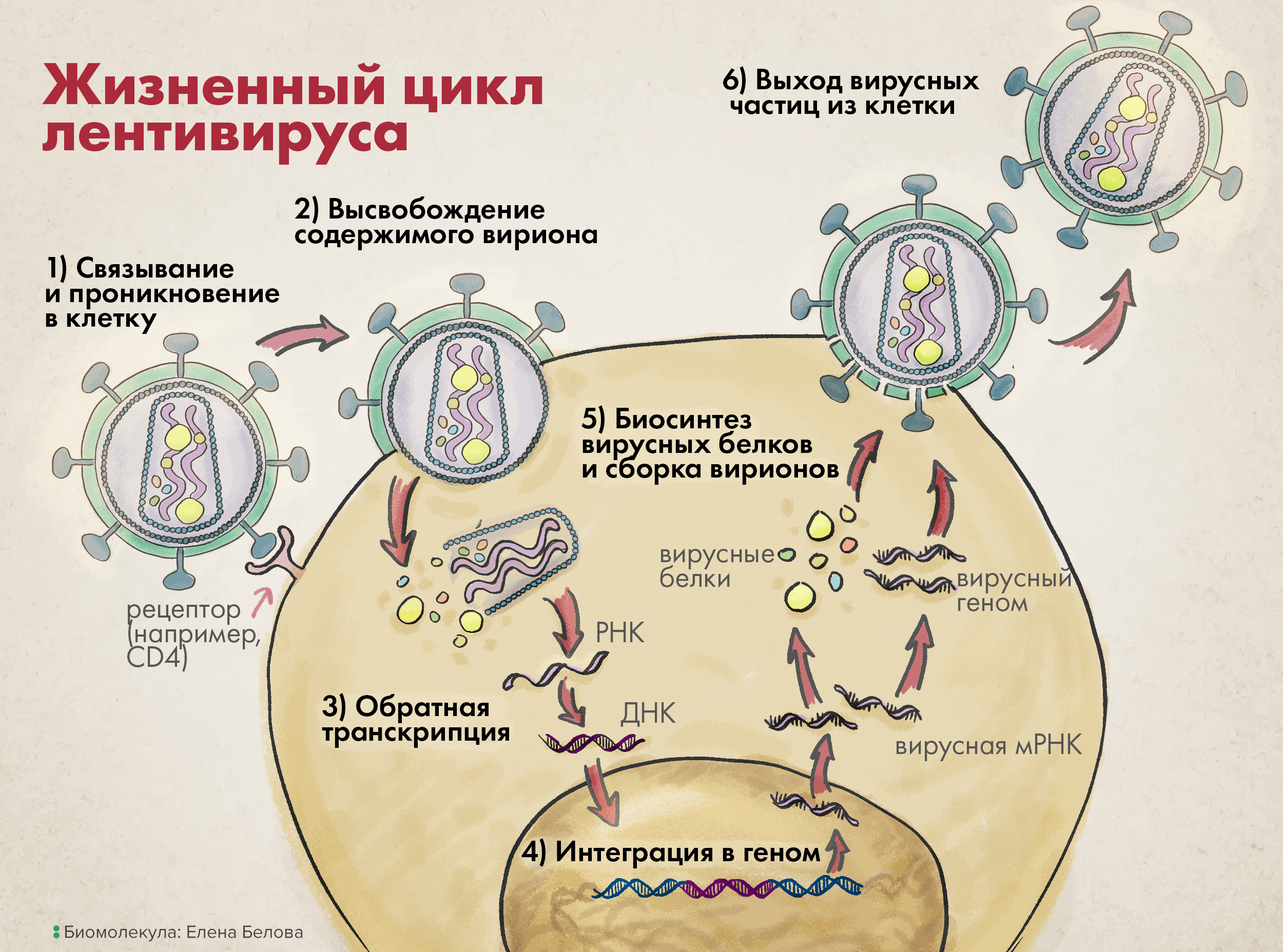
Жизненный цикл лентивируса можно немного обобщить и представить в виде шести основных шагов (рис. 3).
На первой стадии вирион связывается со своей клеткой-мишенью через взаимодействие между белком вирусной оболочки gp120 (SU) и особым рецептором клеточной поверхности.
Существование этих поверхностных и специфичных белков-рецепторов собственно и определяет особую способность вирусов инфицировать строго определенные типы клеток (известную также как тропизм).
Рисунок 3. Жизненный цикл лентивируса. 1. Связь с клеточной поверхностью и проникновение в клетку. 2. Высвобождение содержимого вириона во внутриклеточную среду. 3. Обратная транскрипция. 4. Интеграция в геном. 5. Биосинтез вирусных белков и сборка вирионов. 6. Выход вирусных частиц из клетки.
При инициации цикла заражения вирусом ВИЧ, помимо взаимодействия гликопротеина SU с первичным рецептором СD4 на поверхности лимфоцитов Т-хелперов (что и определяет патогенез ВИЧ-инфекции), происходит также его связывание с корецепторами: CXCR4 или CCR5.
Затем вирусные трансмембранные белки (TM) изменяют свою конформацию, чтобы сблизить вирион и клетку, что приводит к слиянию их мембран и проникновению вируса в клетку (этап 1 на рисунке 3).
После входа в клетку матрикс вируса — то есть все его содержимое, кроме слившегося с мембраной клетки суперкапсида, — распределяется в цитоплазме на составляющие элементы: структурные белки капсида, нуклеиновые кислоты вирусного генома, а также ферменты, необходимые для успешной репродукции генетического материала (этап 2 на рисунке 3).
Используя вирусную РНК как шаблон, а также нуклеотиды зараженной клетки, обратная транскриптаза начинает синтезировать комплементарную вирусную ДНК, а точнее — провирусную ДНК (этап 3 на рисунке 3); последняя затем импортируется в клеточное ядро, вставляясь там с использованием вирусной интегразы в геном клетки-мишени (этап 4).
Дальнейшая репродукция генетического материала идет уже как по нотам: в соответствии с центральной догмой молекулярной биологии. Из последовательности провируса в геноме транскрибируются одноцепочечные (+)РНК, затем с них транслируются вирусные белки (этап 5); они упаковывают вирусные нуклеиновые кислоты так, чтобы в одном вирионе таких последовательностей было две (этап 5).
После этого сформированные вирусные частицы, прорывая цитоплазматическую мембрану, выходят из клетки, формируя из ее фрагментов свой суперкапсид (этап 6 на рисунке 3). Ну а такие новые вирионы заражают уже другие клетки, и весь описанный цикл повторяется [10].
Видео:Генная инженерия за 4 минутыСкачать

Создание лентивирусных векторов
Теперь мы знаем, как структурно устроены лентивирусы, каков их жизненный цикл, но пока еще не разобрались, что собой представляют лентивирусные векторные системы, — как они работают и как их производят. Что же, рассмотрим и этот вопрос.
Безопасность превыше всего
Рекомбинация
Лентивирусы имеют высокую частоту рекомбинации (обмена частями генома между двумя вирусами) и быстро мутируют. Отсюда естественные опасения, что векторы на их основе смогут самопроизвольно воспроизводиться в организме человека и благодаря дальнейшей «перетасовке генов» приводить к появлению суперинфекций. Чтобы снизить подобные риски при разработке векторных систем, основные гены исходных вирусов стали распределять в отдельные плазмиды. При этом полученные векторы (уже неспособные к репликации) — далее еще и последовательно улучшали: на сегодняшний день сменилось уже три поколения таких частиц.
Инсерционный мутагенез
Помимо образования репликационно компетентного вируса, вторым основным риском при применении ретровирусных векторов является онкогенез, возникающий за счет так называемого инсерционного мутагенеза. Критически важно оценивать такие риски, ведь γ-ретровирусы имеют тенденцию встраиваться вблизи генных регуляторных последовательностей, что представляет большую опасность. В частности, в клинических исследованиях с использованием таких частиц фиксировались случаи смерти от развившегося лейкоза [11].
Именно поэтому в поле генной терапии наблюдается постепенное смещение в пользу преимущественного использования лентивирусных векторов, которые намного безопаснее [12]. Они предпочитают транскрипционно активные регионы, но интегрируются в основном в «тело гена» (преимущественно в интроны), избегая энхансеров и промоторов, — что и снижает (и довольно существенно) риски онкогенеза [11], [12].
Поскольку инсерция в транскрипционно активные регионы все же может быть генотоксичной, для усиления биобезопасности разработали так называемые самоинактивирующиеся векторы (self-inactivating, SIN). Они обладают делецией в регионе 3′-LTR вирусного генома: во время обратной транскрипции эта делеция переносится на 5′-LTR провирусной ДНК, что подавляет транскрипционную активность.
Это предотвращает продукцию полноразмерного вируса (после интеграции векторного генома в геном клетки-хозяина), минимизируя тем самым вероятность возникновения репликационно активных вирусных частиц [13]. Более того, такая делеция снижает вероятность, что клеточные кодирующие последовательности, в которые встроился вектор, будут аберрантно экспрессироваться в связи с активностью промотора или через энхансерный эффект. Наконец, дизайн SIN предотвращает потенциальную транскрипционную интерференцию между LTR и промотором, управляющим экспрессией трансгена [13].
Другая повышающая безопасность модификация заключается во включении синтетического инсулятора хроматина в лентивирусные векторы, что снижает взаимодействия между трансгеном и ближайшими к нему генами, также уменьшая возможность аберрантной экспрессии.
Кроме того, правильный подход к дозированию векторов позволяет избегать множественных интеграционных событий в клетке. В идеале требуется подобрать такую дозу, чтобы интеграция происходила в среднем один раз на клетку [12].
В совокупности, все перечисленные меры снижают риск генотоксичности, однако говорить о том, что он сведен на нет, пока еще рано. В нескольких последних исследованиях с использованием лентивирусных векторов были зафиксированы случаи возникновения онкологических заболеваний. В двух из них после проведения расследования испытания продолжили, так как вероятность связи генной терапии и онкозаболеваний посчитали пренебрежимо малой.
Для одного из случаев вопрос о взаимосвязи использования лентивирусных векторов и онкозаболеваний пока остается открытым. Наверное, и мы не будем делать поспешных выводов, ведь с одной стороны, — опасность инсерционного онкогенеза при использовании лентивирусов вполне реальна, а с другой — серьезной статистики по таким случаям нет. Кроме того, в случае очень тяжелых заболеваний, где альтернатива для пациента — постепенное ухудшение состояния и гарантированная смерть через несколько лет, небольшой риск может быть оправдан. Разумеется, ученые при этом не прекращают искать более безопасные способы модификации геномов.
Три поколения векторов
Первые лентивирусные векторные системы содержали три плазмиды: трансферную (transfer), оболочечную (envelope), и упаковочную (packaging).
Упаковочная плазмида содержала бóльшую часть генома исходного вируса: структурные, ферментативные, регуляторные и вспомогательные последовательности, — и не включала гены, кодирующие поверхностные белки вириона. А ведь именно они нужны для связи с клеткой и проникновения в нее, что является ключевым этапом репликативного цикла. Поэтому такие векторные системы (с удаленным геном env) — к репликации уже неспособны, однако уметь проникать в клетку они ведь все же должны — иначе как же они доставят туда целевые гены?
За это отвечает оболочечная плазмида, несущая последовательность вирусного гликопротеина (такого как оболочечный гликопротеин G вируса везикулярного стоматита VSV-G) для помощи векторной частице в связывании с рецепторным белком на поверхности клетки.
Эта технология, основанная на общем свойстве большинства ретровирусов, — возможности формировать так называемые псевдотипы (частицы, в оболочку которых включается поверхностный белок какого-то другого вируса) — позволила расширить диапазон поражаемых ими клеток. Псевдотипированные белком VSV-G векторы обладают уникальными преимуществами: большей стабильностью, а также способностью связываться с рецепторами LDL (липопротеинов низкой плотности), присутствующим на поверхности множества клеток, — что и определяет широкий тропизм этих частиц [10]. Существуют и другие варианты псеводтипирования векторов, расширяющие их тропизм (табл. 1).
| Лентивирусные псевдотипы | Исходный вирус (у которого «позаимствован» поверхностный гликопротеин вирусной оболочки) | Клеточный рецептор, с которым связывается псевдотип | Клеточный тропизм | Эффективность |
|---|---|---|---|---|
| VSV-G | Вирус везикулярного стоматита | LDL-R | Широкий тропизм в не первичных (подвергнутых хотя бы одному пассивированию) культурах клеток | Высокая |
| BaEV | Эндогенный ретровирус павиана | ASCT-1 ASCT-2 | CD34+ клетки | 30% |
| Наивные Т-клетки | До 80% | |||
| Наивные В-клетки | 40% | |||
| В-клетки памяти | 20% | |||
| Натуральные киллеры | 40% | |||
| Ранние тимоциты | До 80% | |||
| RD114 | Эндогенный ретровирус кошек | ASCT-2 | Наивные Т-клетки | До 60% |
| Наивные В-клетки | До 30% | |||
| H/F | Вирус кори | SLAM CD46 | CD34+ клетки | ── |
| Покоящиеся Т-клетки памяти | ── | |||
| Наивные Т-клетки | До 50% | |||
| Покоящиеся В-клетки | ||||
| Покоящиеся гемопоэтические стволовые клетки | До 70% | |||
| Дендритные клетки | ||||
| G/F | Вирус Нипах | EphinB2/B3 | Перициты | 20–40% |
| Клетки эндотелия опухоли | ||||
| COCV | Везиколовирус Кокал | LDL-R | Стимулированные клетки CD34+ | До 80% |
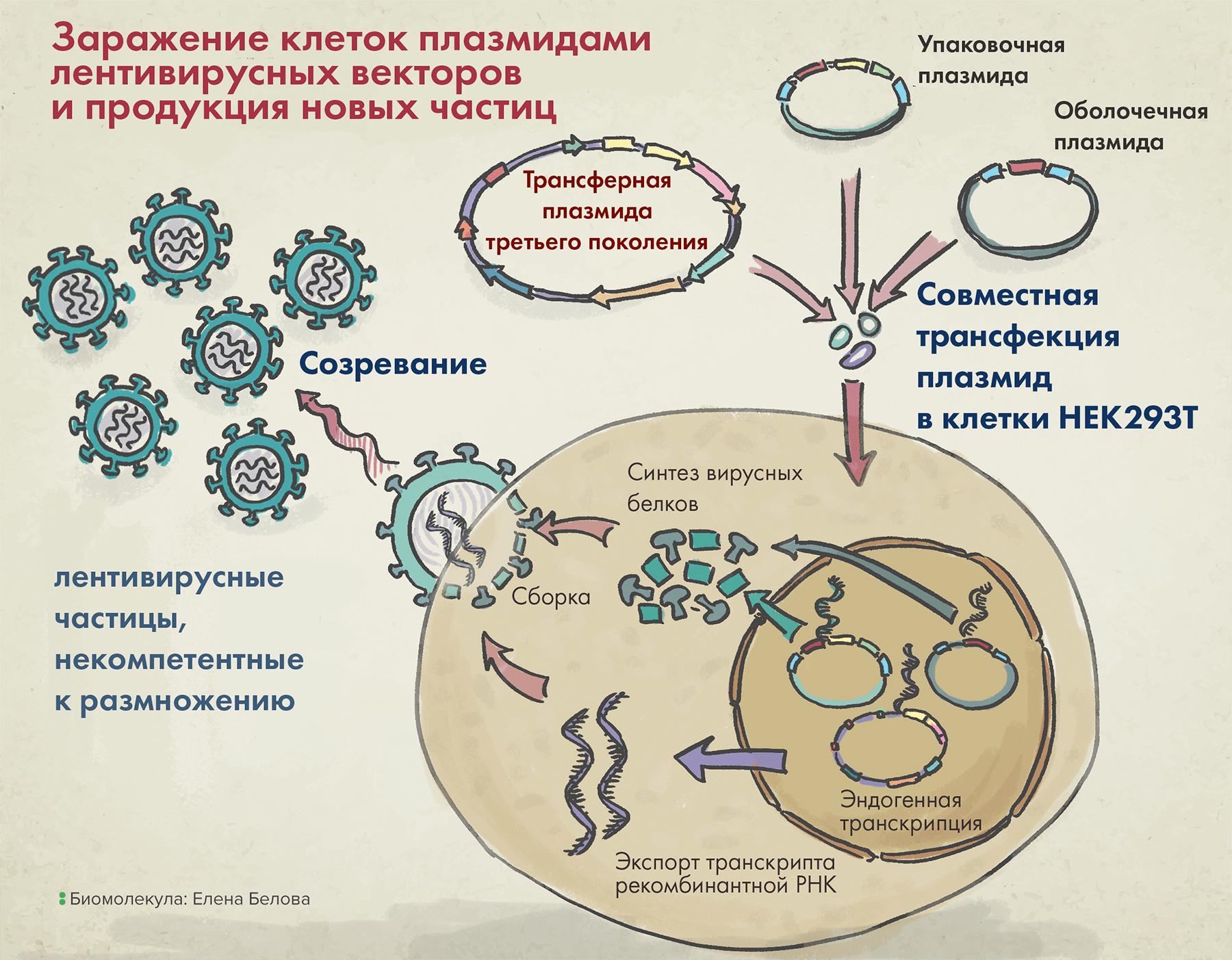
Наконец, последний компонент векторной системы первого поколения — трансферная плазмида — несет целевой трансген, а также так называемую последовательность пси-петли (ψ-петли), — и все это в обрамлении длинных терминальных повторов (long terminal repeats, LTRs). Последние два элемента необходимы для упаковки вирусной РНК в вирион (рис. 4).
Рисунок 4. Упаковка лентивирусных векторов в клетке (на примере третьего поколения таких систем).
После заражения клеток тремя вышеназванными плазмидами в них происходит сборка вирусных частиц, а затем уже их выход наружу. Высвобождаемые векторы содержат VSV-G (он помогает им впоследствии проникать в клетки), но внутри них нет гена, кодирующего этот белок. Так происходит потому, что в кодирующей VSV-G плазмиде отсутствуют генетические последовательности, необходимые для сборки белковой вирусной оболочки, а значит, все ее содержимое запаковаться в вирион уже не сможет.
Поэтому такие частицы умеют доставлять гены в клетку, но не способны размножаться. Чтобы они вдруг снова научились этому, необходима рекомбинация между нашими векторами и, например, природными лентивирусами. Гипотетически это возможно, хоть и маловероятно, — ведь для восстановления репликативно компетентного генома должно многое совпасть: одновременное заражение клеток и вектором, и вирусом, а также прицельный обмен между ними генетическим материалом, — что в силу случайного характера рекомбинации вряд ли случится.
Тем не менее чтобы обезопаситься еще больше, исследователи стали менять исходный геном лентивируса еще сильнее: разбивать его на большее число плазмид, удалять еще больше нецелевых генов, а также модифицировать все необходимые в векторе нативные последовательности. Такие стратегии легли в основу создания лентивирусных векторов второго и третьего поколений (табл. 2).
| Характеристика | Второе поколение | Третье поколение |
|---|---|---|
| Количество плазмид | 3 | 4 |
| Наличие делеции в области U3 в 3′ LTR — для создания самоинактивирующегося вектора (Self-INactivation, SIN) | Нет | Да |
| 5′ LTR | Дикого типа (5′ LTR) | Химерные (RSV) |
| Количество упаковочных плазмид | 1 | 2 |
| Вспомогательные гены: vif, vpr, vpu, nef | Отсутствуют | Отсутствуют |
| tat и rev гены | В упаковочной плазмиде | Ген tat удален, rev в отдельной упаковочной плазмиде |
| gag и pol гены | В упаковочной плазмиде, вместе с tat и rev | Вместе в отдельной плазмиде |
| Псевдотипирование | Псевдотипированы (VSV-G) | Псевдотипированы (VSV-G) |
| Количество рекомбинационных событий, необходимых для генерации репликационно компетентных вирусов | 3 рекомбинации | 4 рекомбинации |
Видео:Константин Северинов. Генетические тесты - фейк? Или лучший способ узнать о себе правду?Скачать

Производство
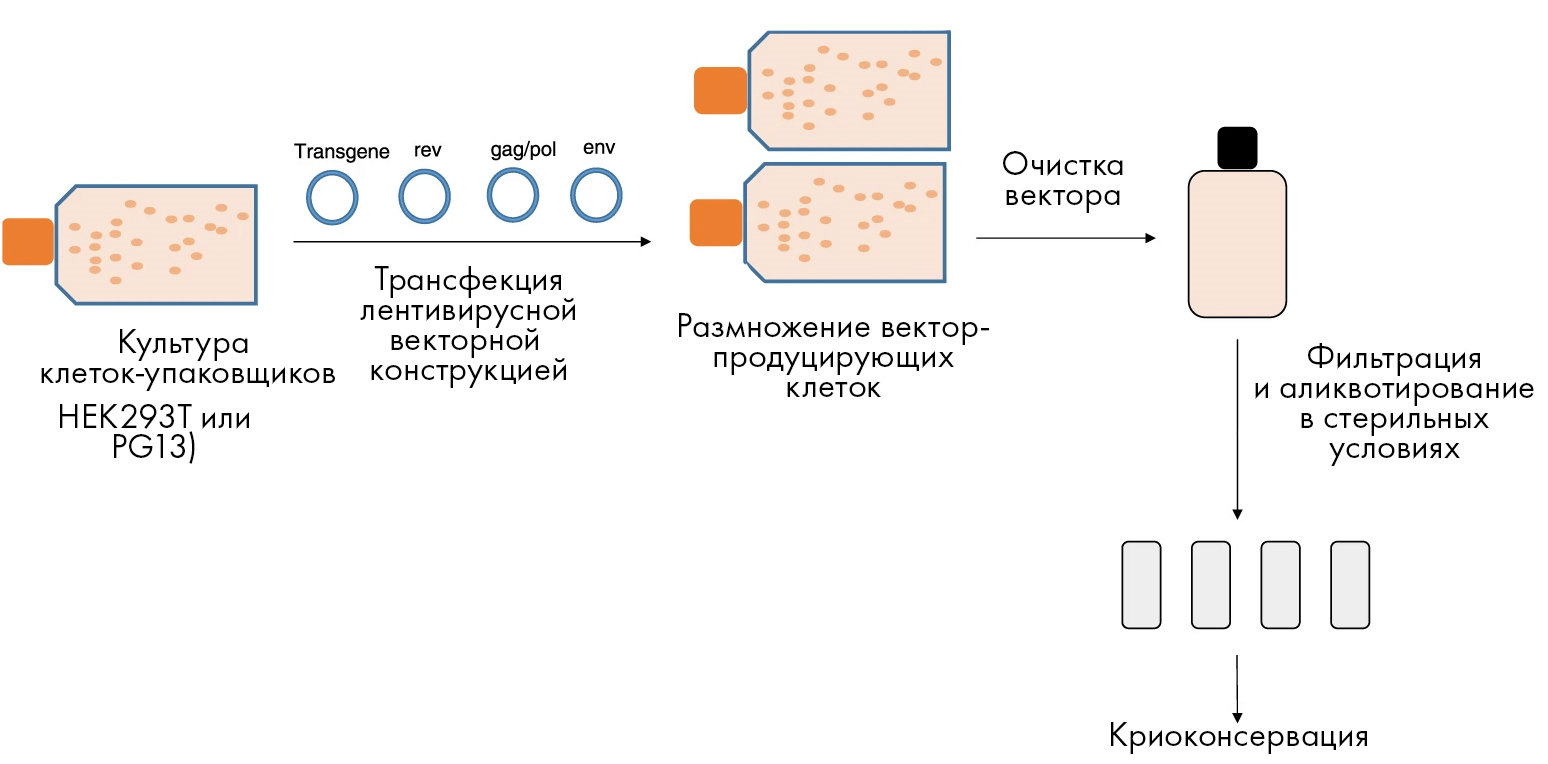
Создание эффективных векторных систем — это лишь первый этап к достаточной продукции нужного материала. Не менее важна разработка технологии производства и ее последующее масштабирование на большие объемы, — чтобы можно было получать требуемые частицы в нужных количествах. При этом в современном мире продукция вирусных частиц для лечебного применения должна идти по Правилам надлежащей производственной практики (известной также как GMP). На рисунке 5 даны основные стадии производства лентивирусных векторов.
Рисунок 5. Основные этапы продукции вирусных векторов на современном производстве, работающем в соответствии с принципами GMP. Все начинается с культуры специальных «клеток-упаковщиков» (таких как HEK293T или PG13). Эти особые упаковочные линии культивируют в течение нескольких дней, заражают плазмидами третьего поколения лентивирусного вектора, и затем уже такие вектор-продуцирующие клетки снова размножают в культуре. После этого векторы выделяют и очищают от остатков клеток (т.н. дебриса: различных клеточных органелл, плазмалеммы и т.д.), а также других загрязняющих примесей. После очистки содержащий векторы полупродукт фильтруют через мембрану с определенным размером пор, не пропускающюю микроорганизмы (что позволяет достичь стерильности). Далее полученный сток асептично распределяют по отдельным аликвотам и криоконсервируют. Сообщалось, что такие замороженные при −80 °С векторы могут сохранять свою стабильность до 9 лет после криоконсервации. Стоит также отметить, что в течение всего описанного процесса очень важен контроль качества, ведь, например, не до конца удаленный из стоков вектора клеточный дебрис может вызывать воспалительные реакции, что было показано в исследованиях как in vitro, так и in vivo [15].
Альтернатива: стабильные упаковщики
Еще один способ получать лентивирусные векторы, помимо временной трансфекции плазмидами, — создание стабильных линий клеток-упаковщиков. Для этого геном клеток (чаще всего это клетки почки человеческого эмбриона HEK293T) модифицируют так, чтобы они смогли стабильно экспрессировать бóльшую часть вирусного генетического материала.
Такие клетки-упаковщики, как правило, экспрессируют гены gag, pol и rev, а зачастую также ген капсида VSV-G. Далее для использования в качестве продуцентов векторов их нужно заразить плазмидой, несущей целевой ген.
Пока что такие стабильные линии используют реже чем «стандартные» клетки-продуценты, ─ но перспективы расширения их применения весьма заманчивы. Они могут осуществлять долгоиграющую экспрессию, что крайне желательно, ─ так как позволит упростить производство, снизив тем самым и его стоимость [16].
Видео:Гомеопатия. Как у меня пригорелоСкачать

Применение лентивирусных векторов в клинике
С момента первых применений лентивирусные векторы стали одним из основных инструментов арсенала генной и клеточной терапии с заметными успехами в клинических исследованиях [17]. Одна из причин — они изначально обладали большим потенциалом благодаря способности эффективно трансдуцировать CD34 + стволовые клетки. Из последних, как известно, в процессе гемопоэза появляются все остальные типы кровяных клеток [18], а потому их генетическая модификация была крайне привлекательна. Ведь после дифференциации эти измененные клетки теоретически смогут остановить (или хотя бы притормозить) патогенез самых разных связанных с ними болезней.
Ученым и медикам оставалось лишь проверить эту теорию практикой, и вскоре перенос генов с использованием лентивирусного вектора в CD34+ стволовые клетки был осуществлен для лечения нескольких генетических заболеваний. Среди них: бета-талассемия, серповидноклеточная анемия, Х-сцепленная адренолейкодистрофия, метахроматическая лейкодистрофия, синдром Вискотта—Олдрича и др. При этом о наличии каких-либо связанных с вектором серьезных нежелательных явлениях в этих исследованиях заявлено не было (о первом тревожном сигнале, связанным с онкогенезом, рассказано выше) [15].
Ранние успехи подстегнули развитие такого лечения, и, согласно регистру клинических испытаний ClinicalTrials.gov, функциональность лентивирусного вектора сейчас уже тестируют более чем в 4000 исследований. При этом известно, что и количество подобных испытаний непрерывно и экспоненциально растет, например: в 2017 г. их было около 200, в 2020-м — более 600 [19], ну а сегодня, как видим, — уже на порядок больше. Из такого обширного поля настоящими прорывами можно назвать уже одобренное лечение, — а это пока что два генных продукта:
- Zynteglo (Bluebird bio, Массачусетс, США) для лечения бета-талассемии.
- Kymriah (Novartis, Базель, Швейцария) для лечения онкогематологических болезней [19].
Они оба представляют собой лечение ex vivo аутологичными генномодифицированными клетками крови пациентов, однако Novartis использует еще и принципиально новый (хоть и разрабатываемый немало лет) подход — внедрение генов для изменения поверхностного рецептора T-лимфоцитов. После модификации такой рецептор способен распознавать специфичные маркеры на опухолевых клетках, — ну а уже измененные T-клетки пациентов уничтожают злокачественные бласты .
Видео:Клонирование ДНК - как и зачем это делаютСкачать

Заключение и перспективы
Одно из направлений улучшения генной терапии — разработка новых векторов-носителей. В частности, представляют интерес не интегрирующиеся лентивирусные векторы (non-integrating lentiviral vectors, NILVs) — они привлекательны в плане снижения вероятности инсерционного мутагенеза. В них выключен фермент вирусная интеграза (как мы помним, отвечающая за внедрение провирусной последовательности в геном клетки) — и они точно так же умеют инфицировать как делящиеся, так и неделящиеся клетки. При этом вирусный геном остается в клетке в виде эписомы, а не интегрируется в геномную ДНК [15].
NILVs стабильно экспрессируют трансгены из эписомальной ДНК в неделящихся клетках, и временно — если клетки-мишени размножаются. Было показано, что такие векторы имеют широкий тропизм ко множеству различных типов клеток и тканей, что вкупе с повышенной безопасностью делает их идеальными кандидатами для использования в вакцинации и иммунотерапии.
Это также открывает перспективы использования NILVs как инструмента для доставки компонентов CRISPR/Cas9 — революционной технологии, которая ныне широко используется в исследованиях генного редактирования. Она включает так называемую направляющую РНК, помогающую распознавать нужные участки генома в клетке для связи с ними нуклеазы Cas9. Последняя начинает в этом месте расщеплять спираль ДНК, создавая двухцепочечные разрывы, которые затем могут быть репарированы определенным образом — с удалением (делецией) каких-либо «поломанных» генов, или внедрением в этом месте каких-то новых кодирующих последовательностей.
Сегодня существуют лентивирусные системы, умеющие доставлять в клетку как направляющие РНК, так и нуклеазу Cas9 (точнее кодирующие их последовательности — для последующей экспрессии).
Лентивирусные векторы также часто используют в исследовательских целях для изменения экспрессии генов посредством использования короткой шпилечной РНК или антисмысловой РНК [23], — что является частью уже известного механизма РНК-интерференции (об этом интересном феномене «Биомолекула» писала уже не раз).
Конечно, пока что большинство из таких перспективных подходов все еще находится на ранних стадиях разработки, и необходимы дальнейшие исследования, чтобы определить, насколько лентивирусные векторы по настоящему «жизнеспособны» — как инструмент для терапевтической доставки компонентов редактирования/регуляции экспрессии тех или иных генов [15].
Видео:Как работает генетическая инженерия.Скачать

Генная инженерия для биотехнологических производств
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Генная инженерия для биотехнологических производств
1. Введение
2. Основные понятия
3. Вектор. Роль плазмидной и фаговой ДНК
4. Основные ферменты, которые использует генная инженерия
5. Этапы
5.1. Предварительный. Отбор микроорганизмов
5.2. Выделение гена. Встраивание его в вектор
5.3. Проникновение вектора
5.4. Проверка культуры на содержание вектора с геном
6. Методика слияния протопластов
7. Генная инженерия. Будущее развитие науки
8. Вывод
9. Список используемой литературы
Генная инженерия. Введение
Генная инженерия является наиболее перспективной и ведущей разработкой в сфере современных биотехнологий. Генная инженерия являет собой революционно новый способ изменения организмов путем непосредственного вмешательства в их геном. Эта наука уже находится на достаточно высоком уровне развития, однако имеет большие перспективы, предоставляя возможность решения многих проблем человечества в сфере медицины, сельского хозяйства и других областях, которые на данный момент являются довольно животрепещущими.
Сущность генной инженерии заключается в том, что, понимая признаки и свойства организма, определяемые тем или иным геном, их можно изменять, удалять или добавлять новые свойства и признаки через изменение, добавление или удаление отдельных генов.
Генная инженерия оказалась очень перспективной для медицины, прежде всего, в создании новых технологий получения физиологически активных белков, используемых в качестве лекарств (инсулин, соматостатин, интерфероны, соматотропин и другие). Инсулин используют для лечения больных диабетом, который стоит на третьем месте (после болезней сердца и рака) по частоте вызываемых смертельных случаев.
Учеными постоянно ведутся разработки препаратов для борьбы с другими сложными и неизлечимыми заболеваниям, в частности с ВИЧ-инфекцией. Сейчас ученые проводят исследования, направленные на получение особого вида белка из генно-модифицированных растений, который способен лишить вирус иммунодефицита человека вирулентности, т.е. предотвратить его распространение, а впоследствии вести профилактику СПИД.
В современной медицине для лечения различных заболеваний используется генотерапия – процесс внесения изменений в генетический аппарат клеток человека. Эта новая область в медицине в настоящее время бурно развивается и направлена на лечение заболеваний, вызванных мутациями в ДНК человека, а также придания клеткам новых функций.
Таким образом, на примере использования методов генетической инженерии в медицине, можно сказать, что генетическая модификация организмов при разумном контроле над этим процессом, способна решить некоторые серьезные проблемы современности.
Генная инженерия является одной из наиболее активно развивающихся и перспективных технологий нашего времени, которая в будущем сможет решить многие вопросы медицины и не только.
Для более четкого и детального понимания процессов генной инженерии и выполнена данная курсовая работа.
Генная инженерия. Основные понятия
Генная инженерия – это совокупность экспериментальных процедур, направленных на получение новых комбинаций генетического материала путем проводимых вне клетки манипуляций с молекулами нуклеиновых кислот и переноса созданных конструкций генов в живой организм, в результате которого достигается их включение и активность в этом организме и у его потомства.
Рекомбинантная ДНК – ДНК , полученная в результате объединения молекулы векторной ДНК , способной к репликации в определенной клетке-хозяине , с ДНК, кодирующей продукт, синтез которого желательно осуществить в этой клетке-хозяине.
Вектор – это фрагмент ДНК, обеспечивающий размножение гибридной ДНК и синтез конечных продуктов деятельности генетической системы – белков.
Ген – участок молекулы ДНК (в нек-рых случаях РНК), в к-ром закодирована информация обиосинтезе одной полипептидной цепи с определенной аминокислотной последовательностью.
Плазмида – фактор наследственности, внехромосомная кольцевая ДНК, которая обладает способностью стабильно существовать в автономном (не связанном с хромосомами) состоянии в цитоплазме.
Ген-маркер – это ген с известной локализацией и проявлением, по деятельности которого можно судить об успешности трансформации (например, гены устойчивости к антибиотикам или гены, отвечающие за синтез белков, светящихся в ультрафиолетовом свете).
Генетическая трансформация — процесс, при котором какой-либо ген (то есть уже трансген) методами генной инженерии переносится в организм. После такого переноса организм называется генетически модифицированным, или трансгенным.
Экспрессия генов — это процесс, в ходе которого наследственная информация от гена (последовательности нуклеотидов ДНК) преобразуется в функциональный продукт — РНК или белок.
Генная инженерия. Вектор
Вектор – молекула ДНК или РНК, состоящая из двух компонентов: векторной части (носителя) и клонируемого чужеродного гена. Задача вектора – донести выбранную ДНК в клетку-рецепиент, встроить ее в геном, позволить идентификацию трансформированных клеток, обеспечить стабильную экспрессию введенного гена.
Таким образом, вектор должен быть небольшим, способным поддерживаться в клетке-хозяине (реплицироваться), многократно копироваться (ампфлицироваться), экспрессировать соответствующий ген (содержать соответствующие регуляторные последовательности), должен иметь маркерный ген, позволяющий различать гибридные клетки для эффективной селекции их; должен быть способен передаваться в клетку соответствующего организма.
Существует несколько типов векторов:
Бактериальные плазмиды
Основная масса клеточной ДНК бактерий содержится в хромосоме (в хромосоме E. coli, например, 4 млн. пар нуклеотидов). Однако кроме хромосом бактерии содержат большое количество очень маленьких кольцевых молекул ДНК плазмид длиной несколько тысяч пар оснований.
Как правило, плазмиды имеют в своем составе гены устойчивости к антибиотикам, ионам тяжелых металлов (R-плазмиды), а также гены, контролирующие катаболизм некоторых органических соединений (плазмиды биодеградации, или D-плазмиды). Поскольку эти гены находятся в плазмидах, они представлены гораздо большим числом копий. Высокая копийность плазмид обеспечивает клетке синтез большого количества ферментов, химически нейтрализующих антибиотики или ксенобиотики, что и обеспечивает устойчивость к последним. Плазмиды, по-видимому, вездесущи, так как их выделяют из разных штаммов и видов бактерий, но не являются обязательными компонентами генома, а в некоторых природных штаммах плазмиды не обнаружены вообще.
Поскольку плазмидная ДНК значительно меньше хромосомной, ее довольно легко выделить в чистом виде. В присутствии ионов кальция плазмиды легко поглощаются бактериями-рецепиентами, даже если те их никогда не содержали, и в клетках бактериального потомства можно обнаружить много копий поглощенной плазмиды. Однако бактериальная клетка обычно может содержать в своем составе плазмиды одного типа. Это явление несовместимости плазмид. Существуют группы несовместимости – Inc-группы (от английского incompatibility – несовместимость). В такой группе может быть несколько плазмид, совместимых между собой, но не совместимых с другими плазмидами. У этих плазмид сходны многие признаки и часто значительна гомология ДНК.
Число копий плазмиды в клетке может существенно варьировать. Это зависит от генетических особенностей как клетки, так и плазмиды. Плазмиды, находящиеся “под ослабленным контролем”, могут размножаться до тех пор, пока их количество не достигнет 10-200 копий на клетку. Если же плазмида находится “под строгим контролем”, она реплицируется с той же скоростью, что и главная хромосома. Такие плазмиды содержатся в клетке в одной или в нескольких копиях. Естественно, что для клонирования рекомбинантных ДНК стараются использовать плазмиды первого типа. Но это не обязательно, так как плазмиды в присутствии хлорамфеникола могут умножаться независимо от деления хромосомы, и количество копий плазмиды может многократно увеличиваться.
Плазмидные векторы, как правило, создают методом генной инженерии, так как природные (не модифицированные) плазмиды лишены ряда обязательных для «высококачественного вектора» свойств:
- Небольшого размера, так как эффективность переноса экзогенной ДНК в E. Coli снижается при длине плазмиды более 15 тысяч пар нуклеотидов.
- Наличия сайта рестрикции, в который осуществлена вставка
- Наличия одного или более селективных генетических маркеров для идентификации реципиентных клеток, несущих рекомбинантную ДНК.
Если фрагмент чужеродной ДНК встраивается в один из генов устойчивости, то последний инактивируется. Следовательно, успешное встраивание фрагмента чужеродной ДНК в один из этих генов легко детектировать по исчезновению у бактерий устойчивости к данному антибиотику. Но при этом сохраняется устойчивость к другому антибиотику. Таким образом вектор дает возможность детектировать только те клоны бактерий, которые содержат рекомбинантную плазмиду.
Вирусы и бактериофаги
Есть вирусы, которые не ведут к гибели клетки, но встраиваются в геном клетки-хозяина и размножаются вместе с ней, либо вызывают ее неконтролируемый рост, т.е. превращают в раковую. К таким относятся ДНК-вирусы SV-40 и вирус полиомы. Внедрение некоторых опухолевых РНК-вирусов ведет к отпочковыванию вирусных частиц от клетки без ее лизиса. К таким вирусам относятся, например, ретровирусы (вирус саркомы Рауса и СПИДа). Для бактериальных клеток в качестве вектора часто используют бактериофаги.
Вирусы являются одними из главных кандидатов на роль векторов для введения чужеродной ДНК. При вирусной инфекции каждая клетка может получить большое число копий чужеродного гена. ДНК можно встраивать так, чтобы она находилась под контролем сильных вирусных промоторов, что обеспечит высокий уровень экспрессии гена, и его продукты будут более доступны для исследования.
Вирус должен быть жизнеспособным после рекомбинирования его ДНК. Легче всего вирусы вводятся в бактерии. Недостатком вирусов как векторов является их небольшая емкость. Кроме того, вирусы заражают небольшой круг хозяев.
Существуют гибридные вектора, содержащие ДНК фага и плазмиды.
Космиды – плазмидные вектора, в которые встроен участок генома фага λ, обеспечивающий возможность упаковки этой молекулы ДНК в фаговую частицу. Фаговые частицы обеспечивают хорошее проникновение гибридной ДНК в клетку (путем инъекции), после чего происходит замыкание ДНК в кольцо по липким концам и репликация ее по плазмидному типу.
Фазмиды также являются гибридами между фагом и плазмидой. После встройки чужеродной ДНК могут в одних условиях развиваться как фаги, в других – как плазмиды.
Вироиды
Из всех известных в настоящее время инфекционных агентов имеют ранг наиболее странных. Известно, что самые мелкие вирусы, способные к независимой репликации, имеют размеры генома, соответствующие молекулярной массе 1 М, то есть около 1500 тыс. пар оснований. Это считали минимальным количеством генетической информации, необходимой для кодирования вирусоспецифических продуктов и подавления метаболизма хозяйской клетки.
Однако в 1971 году были открыты инфекционные агенты, представляют собой очень короткую цепь 1 нитевой ковалентно связанной кольцевой РНК, состоящую из 270-300 нуклеотидов (на три порядка меньше самых минимальных вирусов), не заключенную в белковую оболочку. Это необычные патогены – самые простые и самые маленькие из всех известных.
Каким образом вироиды продуцируют симптомы болезни в инфицированных растениях, не известно до сих пор. Установлено, что они реплицируются ферментами клетки-хозяина, не транслируются в видоспецифичные полипептиды, интегрируются в геном клетки-хозяина.
Вироиды заражают персиситентно (не происходит выздоровления). Вызывают системную инфекцию, т.е. мигрируют из сайта внедрения в другие части растений, переносятся механически или через клеточный сок, через семена, пыльцу. Вироиды также связаны с ядерными фракциями растений и могут размножаться в ядрах.
При работе с вироидами получают 1-нитевую ДНК- копию РНК и достраивают комплементарную нить для получения 2-нитевой ДНК вироида. Такая 2-цепочечная ДНК вcтраивается в плазмиду и передается в клетки E. coli для клонирования. Считывание гена начинается с промотора, который узнается РНК-полимеразой, отвечающей за транскрипцию ДНК в матрицу РНК. Обычно это фрагмент ДНК из 41-44 пар оснований. Ген считывается слева направо, от 5’ к 3’ концу гена и заканчивается в терминальной области гена. За промотором начинается стартовый сайт транскрипции, за которым следует смысловая часть гена. Промоторная область гена содержит определенные короткие сочетания нуклеотидов, характерные для бактериальных генов, или для генов высших организмов. Такие сочетания служат сигналами для РНК-полимеразы, которая присоединяется к промоторной части гена и начинает его считывать.
Однонитевые и двунитевые ДНК способны инициировать репликацию вироида в механически инокулированных растениях табака. Энзиматически in vitro синтезированы также РНК вироидов, высокоинфекционные для растений. Векторные системы могут быть разработаны на основе самих РНК, на основе вироидоспецифичных ДНК, а также в комбинации вироидоспецифичных ДНК с Ti-плазмидами. Вироиды инфицируют своих хозяев в течение всего их жизненного цикла, поэтому в случае использования вироидных векторных систем можно ожидать постоянной экспрессии чужеродного гена в растении.
Хлоропластная и митохондриальная ДНК также привлекают внимание ученых в качестве возможных векторов для переноса генов в клетку. Структурная организация этих клеточных субгеномов существенно различается.
Хлоропласты и другие пластиды обладают одинаковой генетической информацией, так называемым пластомом. У высших растений он представляет собой замкнутую молекулу ДНК длиной 150 т. н. п., достаточную для кодирования примерно 100 белков. Для синтеза пластид необходимо значительно больше белков. Остальные белки кодируются ядром, синтезируются в цитоплазме и поступают в хлоропласты. Некоторые важнейшие белки хлоропластов состоят из нескольких субъединиц, часть из них синтезируется на рибосомах цитоплазмы и транспортируется в хлоропласт, где они объединяются с другими полипептидами, закодированными в самом хлоропласте и там же синтезируемыми. Таким образом, для биосинтеза функционально активного хлоропласта требуется согласованная экспрессия генома и пластома.
Гены растений также способны к экспрессии в клетках Е. coli. Это гены большой субъединцы РБФК. Преимущество хлоропластных генов заключается в том, что их экспрессия в клетках кишечной палочки может быть достигнута путем простого объединения транскрибируемых последовательностей, т.к. в ДНК хлоропластов и бактерий до начала стартовых кодонов трансляции расположена одинаковая нуклеотидная последовательность. Это дает возможность синтезировать растительные экономически важные полипептиды с помощью клеток прокариот.
В отличие от хлоропластной, ДНК митохондрий характеризуются исключительным разнообразием и их величина колеблется от 200 до 2400 т. н. п.. Однако никакой корреляции между размером митохондриального генома и числом белковых продуктов, синтезируемых изолированными митохондриями, не наблюдается. Это явление, а также большие размеры митохондриальной ДНК, по-видимому, можно объяснить присутствием ДНК, бесполезной для функционирования митохондрий.
Транспозоны
Транспозоны – сегменты ДНК, которые контролируют собственную транспозицию (перемещение) из одного сайта ДНК в другой путем вырезания из исходного сайта и внедрения в новый сайт хромосомы или плазмиды.
Механизм перемещения фрагментов ДНК по геному до конца не выяснен. ДНК переносится ферментом транспозазой. Фермент кодируется последовательность длиной около 20 нуклеотидов в середине транспозона. Он специфически взаимодействует с концевыми инвертированными повторами мобильного элемента и может вырезать его из хромосомы. Вырезание может происходить точно – с восстановлением исходной структуры участка ДНК, и неточно, то есть с делециями и вставками от одного до нескольких нуклеотидов. Это приводит к появлению стабильных мутаций и является одним из механизмов создания новых последовательностей ДНК.
Генная инженерия. Биологический смысл перемещения отдельных сегментов ДНК:
– прерывание соответствующего гена, что ведет к эволюции;
– регуляция деятельности генов, так как транспозоны могут нести сигналы для начала считывания генов. В новых областях усиливают или запрещают работу гена.
Транспозоны также участвуют в горизонтальном переносе генов.
У бактерий были обнаружены 2 класса подвижных генов, различающихся по длине и сложности организации.
1. Инсерционные последовательности, или 1S элементы, имеющие длину около тысячи пар нуклеотидов и содержащие только ген, отвечающий за их перемещение.
2. Транспозоны, длиной от 3 до 20 т. н. п., состоящие из ряда дополнительных генов, отвечающих за устойчивость бактерий к различным токсическим веществам.
Поскольку подвижные гены могут перемещаться в пределах генома с одного места на другое, то они могут быть весьма эффективными векторами для передачи рекомбинантной ДНК. Перенос генов при помощи транспозонов имеет большие преимущества, так как он происходит с высокой частотой и не влечет значительных перестроек интегрируемой ДНК. Кроме того, этим методом можно переносить достаточно большие фрагменты ДНК.
Основные ферменты, которые использует генная инженерия
Генная инженерия – потомок молекулярной генетики, но своим рождением обязана успехам генетической энзимологии и химии нуклеиновых кислот, так как инструментами молекулярного манипулирования являются ферменты. Если с клетками и клеточными органеллами мы подчас можем работать микроманипуляторами, то никакие, даже самые мелкие микрохирургические инструменты не помогут при работе с макромолекулами ДНК и РНК. Задача генного инженера – подобрать фермент, который выполнил бы поставленные задачи, то есть смог бы работать с определенным участком нуклеиновой кислоты.
Следует отметить, что ферменты, применяемые в генной инженерии, лишены видовой специфичности, поэтому экспериментатор может сочетать в единое целое фрагменты ДНК любого происхождения в избранной им последовательности. Это позволяет генной инженерии преодолевать установленные природой видовые барьеры и осуществлять межвидовое скрещивание.
Ферменты, применяемые при конструировании рекомбинантных ДНК, можно разделить на несколько групп:
– ферменты, с помощью которых получают фрагменты ДНК (рестриктазы);
– ферменты, синтезирующие ДНК на матрице ДНК (полимеразы) или РНК (обратные транскриптазы);
– ферменты, соединяющие фрагменты ДНК (лигазы);
– ферменты, позволяющие осуществить изменение структуры концов фрагментов ДНК.
Рестриктазы
Рестриктазы (рестрицирующие эндонуклеазы, эндонуклеазы рестрикции) – это ферменты, узнающие и атакующие определенные последовательности нуклеотидов в молекуле ДНК (сайты рестрикции).
Еще в 1953 году было обнаружено, что ДНК определенного штамма E. coli, введенная в клетки другого штамма (например, ДНК штамма В – в клетки штамма С) не проявляет, как правило, генетической активности, так как быстро расщепляется на мелкие фрагменты.
В 1966 году было показано, что это явление связано со специфической модификацией хозяйской ДНК – она содержит несколько метилированных оснований, отсутствующих в немодифицированной ДНК, причем метилирование (добавление к основанию метильной группы) происходит уже после завершения репликации. Бактерия способна отличить свою собственную ДНК от любой вторгающейся «чужеродной» именно по типу ее модификации. За «метку» отвечают метилирующие ферменты модификации, так называемые ДНК-метилазы. Различие в модификации делает чужеродную ДНК чувствительной к действию рестрицирующих ферментов, которые узнают отсутствие метильных групп в соответствующих сайтах.
Системы рестрикции и модификации широко распространены у бактерий; их существование играет важную роль в защите резидентной ДНК от загрязнения последовательностями чужеродного происхождения.
Поскольку разные бактерии по-разному метят свою ДНК, то и рестриктазы должны узнавать разные последовательности. И действительно, с тех пор выделены рестриктазы, узнающие более 150 сайтов рестрикции (мест расщепления ДНК).
В настоящее время известны многие десятки разных рестриктаз, дифференцируемые на рестриктазы, разрезающие либо одну из двух комплементарных нитей ДНК, либо сразу обе нити.
В результате действия рестриктаз в двухнитевой ДНК появляется щель, с двух сторон которой находится по «липкому концу». В эту щель может быть встроен ген – фрагмент ДНК, если он четко обозначен однонитевыми участками, комплементарными однонитевым липким концам, сформированным в результате действия рестриктаз на вектор. Чтобы подготовить включение гена в вектор надо использовать рестриктазу той же специфичности. Следует учесть, что липкие концы не должны образовываться в самом гене. Поэтому, имеют преимущества рестриктазы, распознающие длинные последовательности по порядку расположения пар нуклеотидов. Количество таких последовательностей в молекуле ДНК, которые обнаруживает рестриктаза, резку уменьшается по мере возрастания в них числа пар нуклеотидов. Следовательно, уменьшается возможность повредить рестриктазой сам ген, который включается в вектор в неповрежденном виде.
Все рестрикционные эндонуклеазы бактерий узнают специфические, довольно короткие последовательности ДНК и связываются с ними. Этот процесс сопровождается разрезанием молекулы ДНК либо в самом сайте узнавания, либо в каком-то другом, что определяется типом фермента. Наряду с рестрикционной активностью бактериальный штамм обладает способностью метилировать ДНК; для этого процесса характерна такая же специфичность в отношении последовательностей ДНК, как и для рестрикции. Метилаза добавляет метильные группы к адениновым или цитозиновым остаткам в том же сайте, в котором связывается рестрикционный фермент. В результате метилирования сайт становится устойчивым к рестрикции. Следовательно, метилирование защищает ДНК от разрезания.
Различают 3 основных класса рестриктаз.
Все рестриктазы узнают на двуспиральной ДНК строго определенные последовательности, но рестриктазы 1-го класса осуществляют разрывы в произвольных точках молекулы ДНК, а рестриктазы 2-го и 3-го классов узнают и расщепляют ДНК в строго определенных точках внутри сайтов узнавания или на фиксированном от них расстоянии.
Ферменты типов 1 и 3 имеют сложную субъединичную структуру и обладают двумя типами активностей – модифицирующей (метилирующей) и АТФ-зависимой эндонуклеазной.
Ферменты второго класса состоят из 2 отдельных белков: рестрицирующей эндонуклеазы и модифицирующей метилазы, поэтому в генной инженерии используются исключительно ферменты 2-го класса. Они нуждаются в ионах магния в качестве кофакторов.
Большинство рестриктаз класса 2 узнают последовательности, содержащие от 4 до 6 нуклеотидных пар, поэтому рестриктазы делят на мелко- и крупнощепящие. Мелкощепящие рестриктазы узнают тетрануклеотид и вносят в молекулы гораздо больше разрывов, чем крупнощепящие, узнающие последовательность из шести нуклеотидных пар. К мелкощепящим относятся рестриктазы Hpa II и Alu (из Arthrobacter luteus), к крупнощепящим – Eco R I (из Escherichia coli) и Hind III.
Полимеразы
Впервые ДНК-полимераза была выделена Корнбергом с сотрудниками в 1958 году из E. coli.
ДНК-полимераза I E. coli (Pol I) не связывается с молекулами двухцепочечной кольцевой ДНК. Однако, если такие молекулы денатурировать и получить одноцепочечные формы, то с последними полимераза связывается в количествах, пропорциональных длине этих участков — примерно одна молекула на 300 нуклеотидных остатков. Pol l связывается с одноцепочечными участками двойной спирали ДНК, в местах одноцепочечных разрывов с З’-гидроксилом и 5′-фосфатом, а также с концами двухцепочечных молекул ДНК.
Фермент состоит из мономерной полипептидной цепи с молекулярной массой 103 кДа и имеет 3-х доменную структуру. Каждый домен обладает своей ферментативной активностью: 5’ – 3’ полимеразной, 3’ – 5’ экзонуклезной, 5’ – 3’ экзонуклеазной.
1. 5’— 3′ полимеразная активность. Для реакции необходимо наличие одноцепочечной ДНК-матрицы и комплементарного участку этой цепи фрагмента — праймера (затравки) с З’-ОН концом.
2. 3′- 5′ экзонуклеазная активность. Гидролизует одноцепочечную или двухцепочечную ДНК с З’-ОН конца. 3’—5′ нуклеаза расщепляет диэфирную связь только в неспаренных участках ДНК. Известно, что при полимеразной реакции с определенной частотой возможно включение в растущую цепь некомплементарного нуклеотида. Однако полимераза не может присоединять нуклеотид к неправильно спаренному концу, образовавшемуся при ее участии. На помощь приходит 3’—5′ экзонуклеаза, убирающая ошибочный нуклеотид, на место которого затем присоединяется правильный нуклеотид-предшественник. 3’—5′ экзонуклеолитическая активность проявляется в направлении, обратном синтезу ДНК (см. рис. 34). Таким образом, 3’—5′ экзонуклеазная активность ДНК-полимеразы играет важную роль в точности полимеризации, направляемой матрицей.
3. 5’— 3′ экзонуклеазная активность. Деградирует одну цепь двухцепочечной ДНК, начиная со свободного 5′-конца. В отличие от 3’—5′ экзонуклеазы 5’—3′ экзонуклеаза расщепляет диэфирную связь только в спаренных участках двухцепочечной молекулы ДНК. Более того, в то время как 3’—5′ нуклеаза отщепляет одномоментно только один нуклеотид, 5’—3′ нуклеаза может вырезать с 5′- конца олигонуклеотиды длиной до десяти остатков.
Такое сочетание ферментативных активностей позволяет ДНК-полимеразе I E. coli играть активную роль в репарации повреждений ДНК in vivo.
Обратная транскриптаза
Обратная транскриптаза используется для транскрипции м-РНК в комплементарную цепь ДНК. При изучении ретровирусов, геном которых представлен молекулами одноцепочечной РНК, было обнаружено, что в процессе внутриклеточного развития ретровирус проходит стадию интеграции своего генома в виде двухцепочечной ДНК в хромосомы клетки-хозяина.
Обратная транскриптаза обладает, по крайней мере, тремя ферментативными активностями:
1) ДНК-полимеразной, использующей в качестве матрицы как РНК, так и ДНК;
2) активностью РНКазы Н, гидролизующей РНК в составе гибрида РНК – ДНК, но не одно- или двухцепочечную РНК;
3) ДНК-эндонуклеазной активностью.
Первые две активности необходимы для синтеза вирусной ДНК, а эндонуклеаза, по-видимому, важна для интеграции вирусной ДНК в геном клетки-хозяина. Очищенная обратная транскриптаза синтезирует ДНК как на РНК-, так и на ДНК-матрицах. Чтобы начать синтез, ревертазе, как и другим полимеразам, необходим короткий двухцепочечный участок (праймер).
Лигазы
ДНК-лигаза катализирует синтез фосфодиэфирной связи в 2-х цепочечной молекуле нуклеиновой кислоты. Иными словами, ДНК-лигазы сшивают рядом расположенные нуклеотиды, образуя связь между остатками сахаров. ДНК-лигазы абсолютно необходимы в процессах репарации ДНК, в процессах репликации – при удвоении цепи ДНК.
В генной инженерии используются 2 типа ДНК-лигаз, отличающихся по потребностям в кофакторах и способу действия. ДНК-лигаза E. coli в качестве кофактора использует дифосфопиридиннуклеотид, а лигаза фага Т4 – АТФ в присутствии Mg2+. Лигаза фага Т4 более универсальна, так как помимо лигирования липких концов способна катализировать реакцию воссоединения двухцепочечных фрагментов ДНК с тупыми концами. Она используется чаще.
Генная инженерия. Предварительный этап. Отбор микроорганизма
При выборе микроорганизма как потенциального продуцента учитывается ряд обстоятельств.
1. Поскольку микроорганизм будет выращиваться в производственных условиях в большом количестве и с ним будут контактировать многие работники предприятия (биологи, химики и др.), желательно, чтобы он не был патогенным. Кроме того, целевой генно-инженерный продукт, выделяемый из микроорганизма, должен иметь гарантии отсутствия даже следов микробной токсичности.
2. Проникший в клетку микроорганизма вектор с чужеродным для нее геном (или кластером генов) не должен расщепляться эндонуклеазами этой клетки, т.е генетический материал должен сохраняться. При этом рибосомы потенциального продуцента должны воспринимать информационную РНК, соответствующую чужеродному материалу.
3. Образовавшийся чужеродный для клетки белок (для биотехнолога – целевой продукт) не должен расщепляться ее протеазами, т.е. не подвергаться воздействию систем репарации клетки, гидролизующих чужеродные белки. Ослабление действия таких систем также является одним из предварительных этапов работы генного инженера с продуцентом.
4. Желательно, чтобы у потенциального продуцента чужеродного белка (целевого продукта) последний выводился из клетки в питательную среду, что значительно облегчит его последующее выделение и очистку.
Предварительная работа генного инженера начинается с самого гена, кодирующего целевой белок. К этому гену присоединяется нуклеотидная последовательность, в свою очередь кодирующая так называемую лидерную последовательность аминокислот (преимущественно гидрофобных). Синтезированный в клетке целевой продукт с такой лидерной последовательностью аминокислот с их помощью проходит через липидные слои цитоплазматической мембраны из клетки наружу. Однако в этом случае клетка продуцента должна быть изменена генным инженером. В частности, в мембране должна находиться «сигнальная протеаза», отщепляющая от генного продукта лидерную последовательность аминокислот перед его выходом в среду.
Важным предварительным этапом работы генного инженера является подбор вектора. Векторы, используемые при работе с микроорганизмами, конструируются чаще всего на основе умеренных фагов или плазмид. Преимущество плазмид перед фагами заключается в отсутствии лизиса клетки, возможного при работе с умеренными фагами.
Генная инженерия. Этап 2. Встраивание гена в вектор.
При создании нового рекомбинантного продуцента ключевым моментом в работе генного инженера является встраивание гена в вектор, точнее в ДНК векторной молекулы, например в плазмиду. Это становится возможным благодаря тому, что в распоряжении генных инженеров имеется большой набор разных по субстратной специфичности эндонуклеаз, называемых рестриктазами.
Благодаря действию рестриктаз в двухнитевой ДНК появляется щель, с двух сторон которой находится по липкому концу. В эту щель может быть встроен ген – фрагмент ДНК, если он имеет однонитевые участки, комплементарные однонитевым липким концам, сформированным в результате действия рестриктаз на вектор. Чтобы подготовить включение гена в вектор, надо использовать рестриктазу той же специфичности. Разумеется, липкие концы не должны образовываться в самом гене.
Другой прием, который может быть использован генным инженером – фланкирование гена синтетическими последовательностями нуклеотидов, т.е. получение методами биоорганической химии липких концов с заданным порядком нуклеотидов.
Ген, встроившийся в вектор, удерживается в нем вначале только за счет водородных связей между комплементарными липкими концами. Эта стадия получила название «отжиг». Для того чтобы ген оказался прочно встроенным в вектор, необходимо его закрепление ковалентными связями. Для этих целей служат ферменты – лигазы, замыкающие разрывы в углеводно-фосфатном каркасе ДНК. После этой стадии работы генного инженера вектор с прочно закрепленным в нем геном может вводится в микробную клетку.
Генная инженерия. Этап 3. Введение вектора в клетку.
Способы прямого введения генов в клетку
Прямое введение гена в клетку осуществляют несколькими способами:
- Трансфекция
- Микроинъекция
- Электропорация
- Метод «мини-клеток»
- Упаковка в липосомы
При трансфекции ДНК адсорбируется на кристаллах фосфата кальция. Образуются частицы кальциевого преципитата. Они поглощаются клеткой путем фагоцитоза.
Для повышения эффективности трансформации к специфической ДНК, содержащей ген, по которому будет производится селекция, добавляется неспецифическая ДНК-носитель. Обычно для этой цели берут ДНК из тимуса теленка или спермы лосося. Часть ДНК связывается с мембраной и не попадает в клетки. ДНК акцептируют от 15 до 90% клеток. Через несколько суток после введения небольшая доля клеток способны экспрессировать чужеродные гены, но затем уровень экспрессии падает и более или менее стабильную трансформацию претерпевает 10-3 – 10-5 клеток.
В клетки можно вводить любой ген, если заранее лигировать его с клонированным селективным маркером. Однако дальнейшие исследования показали, что лигирование вне клетки не обязательно. Клетки, поглощающие селективный ген, вместе с ним поглощают и другую ДНК, имеющуюся в кальциевом преципитате. Таким образом, пользуясь методом котрансформации, практически любой клонированный сегмент ДНК можно ввести в культивируемые клетки эукариот, если включить эту ДНК вместе с селективным маркером в состав смеси для образования кальциевого преципитата.
Для обработки клеток-рецепиентов используются грубо очищенные препараты хромосом, так как хромосомы при этом разрушаются меньше всего. Количество хромосом для обработки 1 клетки ограничено. Лучше использовать не более 20 хромосом на 1 клетку-рецепиент, так как при высоких концентрациях хромосом в суспензии они агглютинируют. Рецепиентная клетка содержит фрагменты донорных хромосом, которые могут встраиваться в геном, могут реплицироваться самостоятельно. Во введенных фрагментах часто наблюдаются делеции.
Не все клетки способны к трансформации геномной ДНК с высокой частотой. Человеческие фибробласты эффективно включают плазмидную ДНК и почти не включают геномную.
Микроинъекция ДНК в клетки млекопитающих стала возможной с появлением прибора для изготовления микропипеток диаметром 0.1-0.5 микрона и микроманипулятора. При наличии хорошего оборудования можно за 1 час инъецировать 500-1000 клеток, причем в лучших экспериментах в 50% клеток наблюдается стабильная интеграция и экспрессия инъецированных генов. Преимущество описываемого метода заключается также в том, что он позволяет вводить любую ДНК в любые клетки, и для сохранения в клетках введенного гена не требуется никакого селективного давления.
Электропорация основана на том, что импульсы высокого напряжения обратимо увеличивают проницаемость биомембран. В среду для электропорации добавляют клетки и фрагменты ДНК, которые необходимо ввести в клетки. Через среду пропускают высоковольтные импульсы (напряжение 200 – 350 В, длительность импульса 54 мс), приводящие к образованию пор (электропробой) в цитоплазматической мембране, время существования и размер которых достаточны, чтобы такие макромолекулы, как ДНК, могли из внешней среды войти в клетку в результате действия осмотических сил. При этом объем клетки увеличивается.
Напряженность электрического поля и продолжительность его действия, концентрации трансформирующей ДНК и реципиентных клеток для каждой системы клеток подбирают экспериментально, с тем чтобы достичь высокого процента поглощения ДНК выжившими клетками.
Электропорация — физический, а не биохимический метод, и это обусловливает его широкое применение.
Электропорация — наиболее простой, эффективный и воспроизводимый метод введения молекул ДНК в клетки. Однако до недавнего времени этот метод использовался в ограниченном числе лабораторий в связи с отсутствием серийных приборов — электропораторов. Появление и совершенствование таких приборов в ближайшие годы приведет к широкому применению данного подхода в генетической инженерии самых разных типов клеток.
«Мини-клетки» получают путем блокирования донорных клеток в митозе колцемидом. При продолжительной обработке клеток колцемидом в них вокруг каждой хромосомы формируется новая ядерная мембрана. Обработка цитохалазином В и центрифугирование приводит к образованию мини-клеток, представляющих микроядра, инкапсулированные в цитоплазматическую мембрану.
Полученные мини-клетки очень чувствительны к разного рода воздействиям, поэтому для слияния подбирают специальные мягкие условия. Метод трудный, капризный, эффективность низкая – 10-6 – 10-7.
Упаковка в липосомы используется для защиты экзогенного генетического материала от разрушающего действия рестриктаз.
Липосомы – сферические оболочки, состоящие из фосфолипидов. Получают их путем резкого встряхивания смеси водного раствора и липидов, либо обрабатывая ультразвуком водные эмульсии фосфолипидов. Липосомы, состоящие из фосфатидилсерина и холестерина наиболее пригодны для введения ДНК в клетки животных и растений. Системы переноса с помощью липосом низкотоксичны по отношению к клеткам.
Генная инженерия. Этап 4. Проверка культуры на содержание вектора с геном.
Ген-маркер – ген, который «легко заявляет о себе», т.е маркирует клетку и , соответственно, клон. Ген-маркер также встраивается в вектор, но с помощью другой рестриктазы. Это ген не будет иметь никакого значения в будущем биотехнологическом процессе, но он нужен для отбора продуцента целевого продукта, кодируемого рабочим геном.
Можно выделить 2 группы маркерных генов, позволяющие отличить трансформированные клетки:
1. Селективные гены, отвечающие за устойчивость к антибиотикам (канамицину, тетрациклину, неомицину и др.), гербицидам (у растений). Это могут быть гены ауксотрофности по какому-либо субстрату и т.д. Основной принцип работы такого маркера – способность трансформированных клеток расти на селективной питательной среде, с добавкой определенных веществ, ингибирующих рост и деление нетрансформированных, нормальных клеток.
2. Репортерные гены, кодирующие нейтральные для клеток белки, наличие которых в тканях может быть легко тестировано.
Чаще всего в качестве репортерных используются гены β-глюкуронидазы (GUS), зеленого флюоресцентного белка (GFP), люциферазы (LUC), хлорамфениколацетилтрансферазы (CAT). К настоящему времени из этого арсенала наиболее часто используют гены GUS и GFP и, в меньшей степени, LUC и CAT. Используемый в настоящее время как репортерный ген GUS является модифицированным геном из Escherichia coli, кодирующим β-глюкуронидазу с молекулярной массой 68 кД. GUS активен в широком диапазоне условий среды с оптимумом при рН 5-8 и 37°С.
Он может гидролизовать обширный спектр природных и синтетических глюкуронидов, что позволяет подбирать соответствующие субстраты для спектрофотометрического или флюориметрического определения активности фермента, а также для гистохимического окрашивания тканей in situ (например, в синий цвет). Фермент достаточно стабилен: он устойчив к нагреванию (время полужизни при 55°С составляет около 2 ч) и к действию детергентов. В процессе замораживания-оттаивания потери активности GUS не происходит. В составе химерных белков, созданных генно-инженерными методами, GUS обычно сохраняет свою функциональную активность. В живых клетках белок GUS также весьма стабилен и активен от нескольких часов до нескольких суток.
Генная инженерия. Методика слияния протопластов
Клеточная инженерия –«насильственный» обмен участками хромосом у прокариот или участками и даже целыми хромосомами у эукариот.
С ее помощью возможно получение межвидовых и межродовых гибридных культур микроорганизмов, а также гибридных клеток между отдаленными в эволюционном отношении многоклеточными организмами.
Для обмена фрагментами хромосом у прокариот необходимо предварительно получить из их клеток лишенные клеточной стенки протопласты; затем осуществить слияние (фузию) протопластов с образованием диплоидов; полученные диплоиды инкубировать в течение нескольких часов для ломки и воссоединения кольцевых хромосомных нитей в разных вариантах. Затем суспензию протопластов высевают на твердую питательную среду, при этом часть диплоидов превращается в гаплоиды – способные к размножению клетки, которые образуют колонии. Их изучают и отбирают культуры, приобретающие новые качества, представляющие интерес для биотехнолога.
Таким образом, первый этап работы связан с удалением у микроорганизмов клеточной стенки. У прокариот – эубактерий и актиномицетов – многоклеточных бактерий клеточная стенка состоит из жесткого полимера пептидогликана. Он может быть расщеплен с помощью ферментов (гидролаз пептидогликана), из которых самым известным является лизоцим, расщепляющий полисахаридные нити пептидогликана. Ферментативная деградация клеточной стенки в обычных условиях культивирования бактерий сразу же ведет к их лизису из-за разницы в осмотическом давлении. При этом ни цитоплазма, ни внешняя мембрана не выдерживают целостности.
Удалить клеточную стенку и сохранить целостность протопласта можно, лишь выровняв осмотическое давление внутри клетки и в среде.
Для получения протопластов клеточную стенку удаляют ферментативной обработкой в «гипертонической среде» с 20% раствором сахарозы или маннита, иногда с 10% раствором натрия хлорида в зависимости от определенных особенностей биообъекта. Превращение суспензии клеток в суспензию протопластов обычно контролируют методом фазово-контрастной микроскопии.
Следующий этап работы состоит в объединении суспензий двух образцов протопластов, принадлежащих разным штаммам или разным видам. Частота слияния резко повышается при добавлении к протопластам полиэтиленгликоля, обладающего свойствами детергента.
После промывания гипертонической средой, но уже не содержащей гидролизующего клеточную стенку ферментативного препарата, протопласты высеиваются на твердую питательную среду. При этом часть диплоидов превращается в гаплоиды – способные к размножению клетки, которые образуют колонии. Однако во время нахождения протопластов в диплоидной форме в некоторых из них происходит «ломка» и воссоединение хромосомных нитей, при котором в одну хромосому может включиться фрагмент другой. Таким образом, при регенерации протопластов формируются нормальные клетки, часть которых имеет гибридные хромосомы. Культуры таких клеток обладают новыми свойствами.
После протопластирования выявляются «плюс»- и «минус»-варианты продуцента по сравнению с производительностью исходной культуры. Отбор «плюс»-вариантов затруднений не вызывает, однако сложно добиться их длительного использования в производстве. Для замедления возвращения «плюс»-варинатов к исходным показателям предлагается два пути.
Первый – обработка мутагенами и отбор мутагенов с пониженной способностью к возвращению измененных участков ДНК к норме.
Второй связан с иммобиолизацией биообъектов. Можно связывать клетки с нерастворимыми носителями и использовать в производстве, не прибегая к пересевам в течение определенного времени.
Генная инженерия. Будущее развитие науки
Некоторые футурологи, утверждают, что человек, в принципе, может жить 1 000 лет и больше в том случае, если людям удастся разработать системы замены вышедших из строя органов. Они считают, что эта перспектива не так уж туманна, и уже сейчас есть намеки на то, что она может стать реальностью.
Например, ученые из Университета Миннесоты создали бьющееся сердце, что дает поводы надеется на то, что в будущем, вышедшие из строя органы будут с легкостью заменяться искусственно выращенными. Возможно, дальше будут не только внутренние органы.
Вообще же, считается, что у трансплантации искусственно выращенных органов есть будущее, если органы будут выращиваться из стволовых клеток того, кому требуется пересадка, потому как в этом случае новый орган не будет отторжен организмом как враждебное образование. Кроме того, есть перспективное направление в медицине – генная терапия. Например, благодаря манипуляциям с подменой и инъекцией различных генов, можно будет лечить различные заболевания.
Будущее ставит перед человечеством множество проблем, с которыми эффективно могут справляться люди высокоорганизованные, здоровые с большим интеллектуальным потенциалом. Благодаря генной инженерии и генетике можно будет выращивать отдельные положительные качества людей, как в детском, так и во взрослом возрасте. Человек будет иметь возможность усилить свои умственные способности, иммунитет и продолжительность жизни благодаря лишь внедрению определённых генов в организм. Очень заманчивая перспектива, учитывая, что многие учёные, среди которых первооткрыватели ДНК говорят о том, что глупость основывается на генетике и может быть излечима.
Генная инженерия в перспективе сможет побороть генетические заболевания, и здоровье человека поднимется на новую ступень. Люди избавятся от старения, и им не придётся наблюдать за тем, как увядают их тела. К примеру, известно, что старение вызывается сокращением теломер в процессе деления клеток. Теломеры располагаются на концах хромосом и осуществляют функцию защиты ДНК. В конце 90-х годов двадцатого столетия учёные внедрили в клетку ген, который восстанавливает белок теломеразы, отвечающий за восстановление теломер. Таким образом, учёные сделали клетку бессмертной.
С генетической инженерией связаны надежды на расширение ассортимента микробиологических удобрений и средств защиты растений, увеличение производства метана из бытовых и сельскохозяйственных отходов. Путем выведения микроорганизмов, более эффективно разлагающих различные вредные вещества в воде и почве, можно существенно повысить эффективность борьбы с загрязнением окружающей среды.
Генная инженерия имеет большие перспективы применения для совершенствования штаммов микроорганизмов сегодня кажутся почти неограниченными. Безусловно, будет развиваться такое направление, как создание штаммов-продуцентов белков человека, сельскохозяйственных животных и растений. Это направление связано не только с медициной и ветеринарией, но и с пищевой промышленностью. Близки к завершению работы по созданию микробиологической технологии производства ренина (фермента сычуга телят), используемого в сыроделии, сладкого белка — тау-матина (
в 3000 раз слаще сахара) и других продуктов. Ведутся работы по совершенствованию штаммов дрожжей, используемых в пивоварении и виноделии. Этим организмам передаются гены, которые могут обеспечить усвоение пентоз, разрушение фенольных соединений, конкурентоспособность при росте в нестерильных условиях.
Начаты работы по созданию процесса переработки крахмала в этиловый спирт с помощью бактерий, что значительно ускоряет и удешевляет его производство.
Вывод
Генная инженерия открыла принципиально новые возможности, дальнейшего развития молекулярной генетики, особенно тех ее разделов, которые связаны с выяснением особенностей устройства наследственного аппарата высших растений, животных и человека, генная инженерия позволяет менять наследственную основу любого живого организма путем непосредственного изменения генетической информации.
Благодаря генно-инженерным методам многократно повышается продуктивность традиционных микробов — продуцентов веществ, используемых в пищевой, кормовой, лекарственной, витаминной и других отраслях промышленности, становится возможным организовать микробиологическое производство принципиально новых эффективных вакцин и средств диагностики, многих ценных материалов, резко повысить эффективность использования удобрений, внести революционные изменения во многие другие сферы промышленной и сельскохозяйственной микробиологии.
Одной из главных сфер приложения генной инженерии становится селекция сельскохозяйственных растений и животных. Она дает возможность сознательно и высокоэффективно управлять наследственностью. С помощью генной инженерии появляется возможность создавать такие формы животных и растений, которые сочетают высокую продуктивность с устойчивостью к болезням, вредителям, паразитам и неблагоприятным факторам.
Вместе с тем использование методов генной инженерии требует особой осмотрительности и осторожности, поскольку затрагивает законы жизнедеятельности и эволюции. Развитию исследований в области генной инженерии в нашей стране придается большое значение.
🎥 Видео
Изменить ДНК у себя дома? | DIY-биологияСкачать

Софья Феоктистова. Вирусные вектора (ААВ, АВ, Ленти)Скачать

Биотехнология и её направления. Клеточная и генная инженерия | Биология с Альбиной АмировойСкачать

Гены и злодействоСкачать