Вирусные векторы — современный инструмент для доставки генетического материала в клетку. Рассмотрены различные типы вирусных векторов, таких как ретровирусные, аденоассоциированные и лентивирусные векторные системы, векторные системы на основе аденовирусов, вируса герпеса простого и поксвирусов. Более подробно представлены аденоассоциированные векторные системы. Их основные преимущества (способность интегрировать целевой ген в нужное место генома хозяина, что предотвращает нежелательные мутации; встраивание как в делящиеся, так и в покоящиеся клетки; широкий профиль трансдукции; низкий иммунный ответ; сильная и устойчивая экспрессия трансгена) сделали эти векторы популярным и универсальным инструментом для доставки генов in vitro и in vivo . Показаны возможности применения вирусных векторов в нейробиологии.
В настоящее время вирусные векторы — распространенный инструмент для доставки генетического материала в клетку. Именно благодаря особенностям жизненного цикла вирусов первые векторы (носители трансгенов) стали разрабатывать на их основе [1]. Вирусы переносят чужеродные гены, которые способны экспрессироваться в зараженных клетках [2]. Сейчас вирусы эволюционировали в специализированные молекулярные механизмы, способные эффективно транспортировать их геномы внутрь клеток, которые они заражают [3].
Разнообразие вирусных векторов велико, и каждый имеет свои преимущества и недостатки. Сейчас значительные усилия направляются на разработку вирусных векторов с улучшенными характеристиками безопасности и большей эффективностью доставки нуклеиновой кислоты в клетки, а также на обеспечение длительной и тканеспецифичной экспрессии введенного генетического материала. Потенциально вирусные векторы могут применяться как один из способов доставки генов в генной терапии новообразований и наследственных заболеваний.
Рекомбинантные аденоассоциированные вирусы (рААВ) являются одними из наиболее перспективных векторов доставки для генной терапии благодаря своим непатогенным свойствам, отсутствию иммуногенности со стороны хозяина и тропности к большинству клеток и тканей [4]. Аденоассоциированные вирусные векторы по своим характеристикам приближаются к идеальному вектору [5].
Вирусные векторы нашли свое применение и в нейробиологии в качестве систем эффективной доставки генов в нейроны и другие нейрональные клетки in vitro и in vivo. Вирусные векторы позволяют вести наблюдение за нейробиологическими функциями, изменять экспрессию целевых генов, метить клетки для определения их судьбы и менять физиологическое состояние специфических клеточных популяций. Использование вирусных векторов для доставки генов в нервную систему имеет большие перспективы как для фундаментальных исследований, так и для терапевтического применения.
Типы вирусных векторов, используемых в нейробиологии
Существуют вирусные и невирусные системы доставки генетического материала. Вирусные системы включают векторы, разработанные на основе ретровирусов, аденовирусов, аденоассоциированных вирусов, лентивирусов и вирусов простого герпеса. Невирусные системы включают «голую» ДНК и липиды или полиэтилгликоль [4]. Независимо от того, какой геном имеют вирусные векторы в своем составе — ДНК или РНК, у них похожий жизненный цикл, который начинается с взаимодействия со специфическим рецептором на поверхности клетки. После адсорбции вириона на клеточной поверхности в процессе проникновения геном вирусов подвергается «раздеванию». При реализации внутриклеточной стадии жизненного цикла вирус осуществляет три молекулярных процесса: репликацию геномной нуклеиновой кислоты, транскрипцию и трансляцию. На каждой стадии вирус вмешивается в клеточные синтетические механизмы и подчиняет их своим задачам, создавая приоритеты для вирусных нуклеиновых кислот [6].
Ни ДНК, ни РНК не могут быть использованы в «голом» виде для доставки генов в клетки-мишени. Сахарофосфатный остов молекул нуклеиновых кислот располагается по их периферии полярными группами наружу, придавая им анионные свойства [7]. При физиологических значениях рН нуклеиновая кислота несет отрицательный заряд, отталкивающий ее от отрицательно заряженной наружной поверхности клеточной мембраны. Еще одно ограничение при проникновении в клетку нуклеиновой кислоте создает ее гидрофильность [8]. Все ее гидрофобные основания «повернуты» вовнутрь молекулы, поэтому она не может проникнуть через гидрофобный барьер клетки-мишени [9]. В сыворотке крови нуклеиновая кислота быстро деградирует под воздействием нуклеаз. Период полужизни немодифицированной интерферирующей РНК в сыворотке крови укладывается в 5–60 мин, для ДНК он составляет не более 10 мин [10]. Кроме того, нуклеиновые кислоты не способны специфически узнавать клетки-мишени. Поэтому для доставки генов в эукариотические клетки с начала 1980-х гг. разрабатываются векторные генетические конструкции [11].
Ретровирусные векторные системы
Ретровирусы относятся к группе вирусов, РНК-геном которых в инфицированных клетках конвертируется в ДНК. Геном ретровирусов образован плюс-цепью РНК и включает три структурных гена (gag, pol и env), фланкированных длинными терминальными повторами (LTR, long terminal repeat) [12]. В LTR содержатся регуляторные элементы, которые играют роль во встраивании ретровируса и необходимы для интеграции ДНК-копии генома вируса с геномом хозяина, а также определяют начало и конец вирусного генома. LTR также контролируют экспрессию вирусных генов [13]. Оболочка ретровирусов состоит из цитоплазматической мембраны зараженной клетки и вирусных белков [14]. Особенностью жизненного цикла ретровирусов является обратная транскрипция в зараженной клетке на матрице вирусной РНК с образованием двухцепочечной ДНК (провирус), которая затем встраивается в клеточный геном. Вирус встраивается в клеточный геном случайным образом, поэтому возрастает риск инсерционного мутагенеза. Так как эти вирусы заражают только делящиеся клетки (для проникновения в ядро необходимо разрушение ядерной оболочки клетки, происходящее в ходе митоза), ретровирусные векторы используют в основном для трансфекции клеток ex vivo или для лечения злокачественных опухолей [15]. Сами ретровирусные векторы получают на основе провируса, из которого удаляются гены gag, pol и env для предотвращения репродукции вируса и освобождения места для желаемого генетического материала. В вектор на основе ретровируса может быть включено до 8 тыс. пар оснований ДНК-вставки. Для репродукции вируса удаленные вирусные гены (gag, pol, env), которые кодируют вирусные белки и обеспечивают репродукцию вируса, встраивают в геном упаковывающей клеточной линии на разные хромосомы так, чтобы снизить вероятность обратной рекомбинации вирусных генов в исходный вирусный геном и образования вирусов, которые могут репродуцироваться [16].
Лентивирусные векторные системы
Лентивирусы относятся к семейству ретровирусов и в отличие от других ретровирусов инфицируют не только делящиеся, но и неделящиеся клетки. Наиболее исследованным лентивирусом является вирус иммунодефицита человека (ВИЧ). В связи со способностью лентивирусов включать большое количество генетического материала (до 8 тыс. пар оснований) и инфицировать делящиеся и неделящиеся клетки, эти вирусы являются перспективным вектором для доставки генов в условиях in vivo [17]. Геном ВИЧ включает три гена структурных белков (gag, pol и env) и 6 генов регуляторных белков (tat, rev, vpr, vpu, nef и vif) [18, 19]. Некоторые гены могут быть исключены из генома вируса и при этом не вызвать снижения вирусной способности к размножению и инфицированию клеток. Лентивирусный жизненный цикл похож на жизненные циклы других ретровирусов, за исключением способности заражать и неделящиеся клетки. Эта способность обеспечивается взаимодействием вирусного преинтеграционного комплекса с ядерной оболочкой и транспортом через нее [20]. Сборка лентивирусного вектора происходит в упаковывающих клетках — это перевиваемые клетки, осуществляющие синтез вирусоспецифических белков [21]. Упаковывающие клетки включают в себя пакующую, векторную и оболочечную кассеты, которые вместе позволяют собрать функциональную вирусную частицу [22, 23]. При этом их одновременная экспрессия не вызывает образования ретровирусных частиц, способных инициировать инфекционный процесс у человека [24].
Лентивирусы имеют сравнительно небольшой объем вставки целевого гена (до 8 тыс. пар оснований), могут обеспечить длительную экспрессию трансгена и индуцируют минимальный иммунный ответ организма-хозяина [25]. Некоторые авторы считают эти векторы малоподходящими для доставки in vivo, так как они увеличивают риск инсерционного мутагенеза. Однако при использовании лентивирусов для трансдукции дифференцированных клеток риск инсерционного мутагенеза меньше, чем при использовании других ретровирусов [26].
Векторные системы на основе аденовирусов
Аденовирусы — семейство ДНК-вирусов, несущих в своем составе одну двуцепочечную молекулу ДНК и лишенных липидной оболочки. Аденовирусы разделены на основе связывания со специфическими сыворотками на 51 серотип [27], а по способности агглютинировать эритроциты у людей, кроликов и мышей и по онкогенности для грызунов — еще на 6 субгрупп (от A до F) [28]. Аденовирусы разных субгрупп поражают различные органы и ткани человека [29].
Создание рекомбинантных аденовирусных векторов во многом схоже с созданием лентивирусных векторов. Аденовирусы, дефектные по репликации, получали за счет замены гена Е1, необходимого для репликации, на ген интереса, промотор и энхансер [30]. При этом такие рекомбинантные векторы эффективно размножаются в пакующих клетках, экспрессирующих продукт гена Е1. Неспособные к репликации вне пакующих клеток аденовирусные векторы используют для введения трансгенов в условиях in vivo [31]. Рекомбинантные аденовирусные векторы обеспечивают очень высокую экспрессию клонированных генов, но на короткое время (5–10 сут) — из-за иммунного ответа организма-реципиента [32]. Для решения этой проблемы было создано второе поколение аденовирусных векторов, у которых дополнительно к гену Е1 удалили гены, отвечающие за репликацию вируса, и оставили только элементы, определяющие начало и конец генома и вирусную пакующую последовательность [33]. Такие векторы способны к более длительной экспрессии генов [14].
Аденовирусы способны инфицировать большинство типов клеток (делящиеся и неделящиеся). Объем для вставки целевого гена составляет 20 тыс. пар оснований, что является достаточно большой емкостью рекомбинантных аденовирусных векторов. Аденовирусы реплицируются в ядре инфицированной клетки как эписомные элементы и обладают высокой эффективностью трансдукции. Так, например, после прямой внутричерепной инъекции рекомбинантного аденовируса была обнаружена его способность заражать нейроны, астроциты, олигодендроглию, эпендимоциты, хориоидальный эпителий и микроглию [34, 35].
Векторные системы на основе вируса простого герпеса
Вирусные векторы на основе вируса простого герпеса (herpes simplex virus, HSV) имеют конструкцию проще, чем векторы на основе аденовирусов. Сам вирус включает около 80 генов, один из которых (IE3) чаще всего замещается при создании вектора [36]. Исключены могут быть и другие гены, что позволяет увеличить объем вектора или заклонировать несколько генов интереса. Недостатками векторов на основе вирусов простого герпеса являются кратковременная экспрессия клонированных генов, токсичность для клеток-мишеней, низкая эффективность трансдукции и способность заражать только неделящиеся клетки [37].
Для создания вирусных векторов сейчас активно используются ампликоны — многократно повторяющиеся последовательности вируса простого герпеса, которые включают мономерные последовательности, организованные как конкатемеры [38]. Каждый мономер включает хотя бы один участок начала репликации вирусной ДНК (oriS или oriL) и последовательность для упаковки ДНК в вирусную частицу (pac) [39]. Молекулярное клонирование этих последовательностей в бактериальную плазмиду позволяет получить вектор, который упаковывает ДНК в вирион HSV. Такие векторные системы способны включать до 150 тыс. пар оснований чужеродной ДНК, что предоставляет возможность одним вектором доставлять в клетку-мишень несколько транскрипционных единиц, не вызывая при этом иммунного ответа и цитопатического эффекта [40]. Особенность жизненного цикла вирусов простого герпеса — наличие двух стадий инфицирования: активной (проникновение и репродукция в клетках эпителия, приводящие к лизису клеток) и латентной (внедрение и репродукция в нервных клетках) [41]. Лизис клеток происходит за счет того, что при репликации вируса сформировавшиеся вирионы покидают клетку путем почкования ядерной мембраны.
Вирусы простого герпеса — нейротрофичны и высокоэффективны при изучении ретроградного и антероградного транспорта в ЦНС, могут быть введены в неопасном латентном состоянии. HSV-векторы имеют большую генетическую емкость и могут обеспечить долгосрочную экспрессию трансгена, однако, как отмечалось выше, основным недостатком их являются токсичность для клеток и низкая эффективность трансдукции [24].
Векторные системы на основе поксвирусов
Поксвирусы — крупные вирусы, которые содержат двунитевую ДНК. Поксвирусный вектор позволяет включить до 25 тыс. пар нуклеотидов ДНК интереса без исключения генов самого вируса. Векторные системы на основе поксвирусов не имеют такого широкого применения, поскольку эукариотические промоторы неэффективно распознаются транскрипционными механизмами поксвирусов и для эффективной экспрессии рекомбинантных генов в клетке-реципиенте нужно использовать поксвирусные промоторы [42]. Поксвирусные транскрипты не подвергаются сплайсингу, из-за чего ДНК интереса обязательно должна быть представлена в форме комплементарной ДНК. Особенностью жизненного цикла поксвирусов является наличие собственной ДНК-зависимой РНК-полимеразы, которая обеспечивает считывание более половины вирусного генома в течение начальной и ранней стадий репродуктивного цикла. Вследствие большого размера и неинфекционной природы поксвирусной ДНК чужеродные гены клонируются в поксвирусах путем рекомбинации в условиях in vivo. Поксвирусы обладают природным тропизмом к опухолевой ткани [43].
Главными недостатками поксвирусов являются высокая иммуногенность, кратковременная продолжительность экспрессии и сложности репликации в эукариотических клетках. При этом положительными сторонами поксвирусов служат высокая эффективность трансдукции, емкость и способность заражать большинство типов клеток [44].
Аденоассоциированные вирусные системы и их преимущества
Рекомбинантные аденоассоциированные вирусы (ААВ) являются одними из наиболее перспективных векторов доставки для генной терапии и нейробиологии благодаря своим непатогенным свойствам, низкой иммуногенности со стороны хозяина, тропности к большинству клеток и тканей, высокой эффективности трансдукции и продолжительной экспрессии [45]. Основной их недостаток — небольшая емкость вектора (до 5 тыс. пар оснований).
Всего у ААВ известно 8 различных серотипов. ААВ2, ААВ3 и ААВ5 первоначально были выделены у обезьян [46]. Полагают, что ААВ6 был сформирован путем рекомбинирования ААВ2 и ААВ1, а именно 5’-конец ААВ2 слился с 3’-концом ААВ1 (включая две открытые рамки считывания) [47, 48]. ААВ7 и ААВ8 были выделены от макаки-резуса при ПЦР-амплификации с использованием праймеров, полученных из консервативных областей серотипов ААВ1–ААВ6 [49]. Среди всех восьми серотипов ААВ2 является наиболее изученным и широко используется в качестве вектора доставки генов [5].
ААВ принадлежит к семейству Parvoviridae. Это группа безоболочечных вирусов, содержащих одноцепочечную ДНК. Вирусная частица имеет икосаэдрическую (20 граней) симметрию с диаметром 18–26 нм и молекулярную массу 5,5–6,2 МДа [50].
Наиболее характерными особенностями ядерной структуры являются группы тройных выступов и выступающих петель, расположенных между двумя смежными субъединицами [51]. Положительно заряженные группы, расположенные вдоль одной стороны каждого выступа, отвечают за связывание с клеточным рецептором — гепарансульфат протеогликаном (HSPG) [52]. В связи с высокой экспрессией данного рецептора в разных тканях связывание с HSPG определяет широкий спектр клеточной специфичности к ААВ2-инфекции [53]. Петля, расположенная в соседней субъединице, также участвует в связывании с клеточным рецептором HSPG и содержит эпитоп для нейтрализующих антител [5]. Нейтрализация иммунного ответа определяет возможность будущего успешного повторного попадания вирусных векторов. Анализ структуры вирусных частиц ААВ2 с помощью рентгеновского излучения открыл возможность изменения эпитопа, содержащегося в вирусных белках капсида, и нейтрализующего антитела и осуществления других модификаций, применимых для реадмиссии в генной терапии [54].
ААВ2 имеет одноцепочечную геномную ДНК, состоящую из 4680 оснований. Инвертированные концевые повторы, состоящие из 145 оснований с высоким содержанием пар GC и способные образовывать палиндромную структуру, расположены как на 5’-конце, так и на 3’-конце [55]. ААВ2-геном синтезируется с мРНК, начиная от промотора p19 [56]. Ген cap кодирует три вирусных белка: VP1 (735 аминокислот, 90 кДа), VP2 (598 аминокислот, 72 кДа) и VP3 (533 аминокислот, 60 кДа), образующих вирусный капсид в соотношении 1:1:20 соответственно, при этом капсид имеет икосаэдрическую симметрию и состоит из 60 субъединиц [57]. Три капсидных белка синтезируются с одной мРНК, начиная с промотора р40, и отличаются друг от друга благодаря альтернативному сплайсингу и разным кодонам инициации [58]. Все три белка капсида имеют одни и те же карбоксиконцевые последовательности и стоп-кодоны (рис. 1).
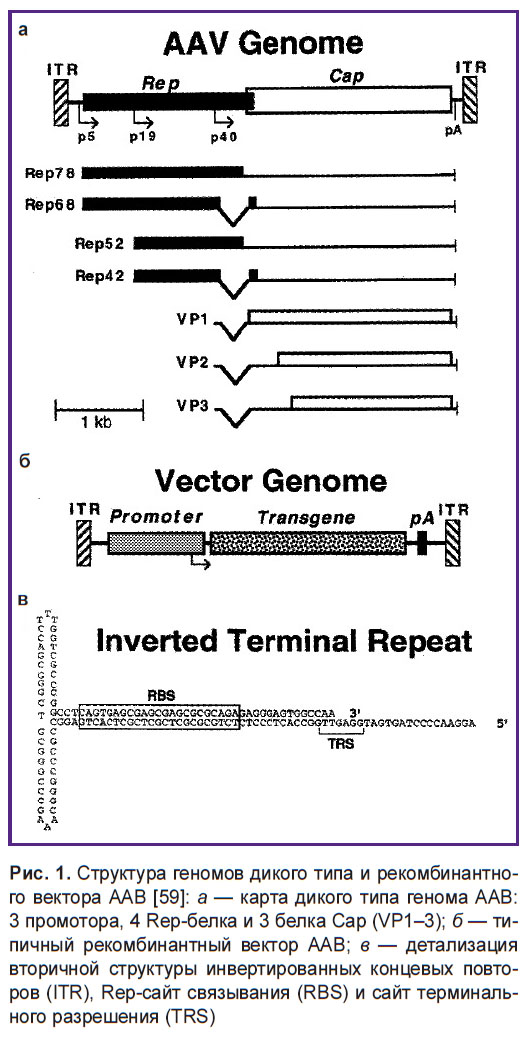 | Рис. 1. Структура геномов дикого типа и рекомбинантного вектора ААВ [59]: а — карта дикого типа генома ААВ: 3 промотора, 4 Rep-белка и 3 белка Cap (VP1–3); б — типичный рекомбинантный вектор ААВ; в — детализация вторичной структуры инвертированных концевых повторов (ITR), Rep-сайт связывания (RBS) и сайт терминального разрешения (ТRS) |
Инвертированные концевые повторы на обоих концах выполняют по крайней мере следующие три функции. Во-первых, 3’-конец служит в качестве праймера для синтеза новой нити ДНК. Во-вторых, он имеет Rep-связывающий сайт (RBS) для Rep78 и Rep68, которые обладают хеликазной, цепьспецифической и сайтспецифической эндонуклеазной активностью [60]. В-третьих, там находится концевой сайт прикрепления (ТRS), который идентичен последовательности в 19-й хромосоме и выступает в качестве последовательности для интеграции с вирусным геномом [61].
Инфекционный путь ААВ2 включает несколько стадий (рис. 2). Вирусные частицы сначала прикрепляются к клеточной поверхности путем связывания с рецептором и корецептором, что в свою очередь ведет к интернализации и включению во внутриклеточный транспорт [62]. Затем эти частицы проникают через ядерную мембрану и либо интегрируют свои геномы с геномом клетки-хозяина, либо реплицируют свой геном внутри ядра [63]. Общепризнано, что основным клеточным рецептором для связывания ААВ2 является HSPG [64].
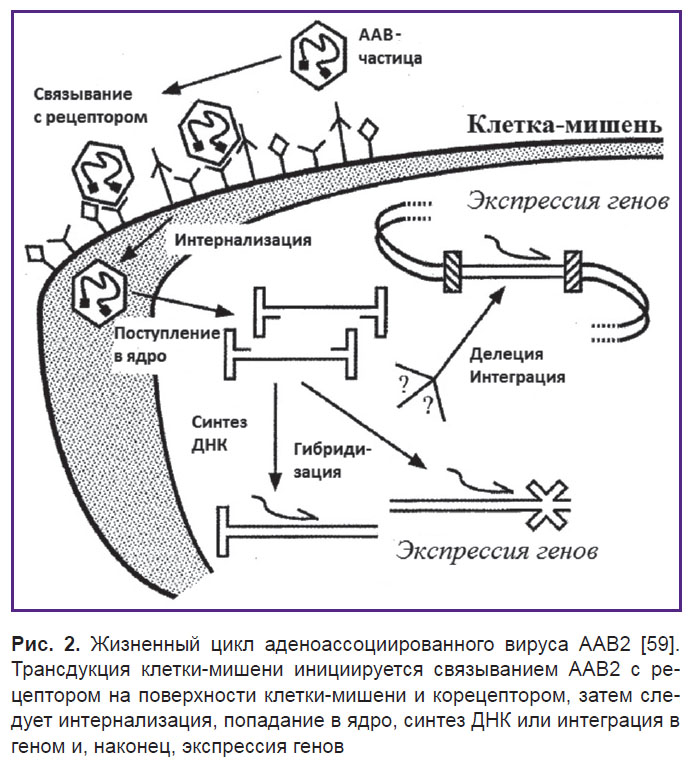 | Рис. 2. Жизненный цикл аденоассоциированного вируса ААВ2 [59]. Трансдукция клетки-мишени инициируется связыванием ААВ2 с рецептором на поверхности клетки-мишени и корецептором, затем следует интернализация, попадание в ядро, синтез ДНК или интеграция в геном и, наконец, экспрессия генов |
Благодаря анализу сайтнаправленного мутагенеза была обнаружена важность основных аминокислот в связывании капсида ААВ2 с гепарином [65].
HSPG выступает в качестве основного рецептора, но ААВ2 также связывается с корецепторами — рецептором 1 фактора роста фибробластов (FGFR1) и αvβ5-интегрином [66, 67]. FGFR1, как полагают, увеличивает степень прикрепления вируса к клетке, в то время как αvβ5-интегрин необходим при эндоцитозе [68, 69]. После эндоцитоза вирусные частицы ААВ2 освобождаются от эндосомы при низком рН [70, 71]. Низкий рН, вероятно, вызывает конформационные изменения вирусных белков, которые играют решающую роль в успешном выходе из эндосомы и проникновении в ядро [72, 73].
В одних ядрах геном ААВ интегрирует в 19-ю хромосому в качестве провируса, а в других вирусные геномы могут оставаться как эписомы [5].
Хелперные плазмиды. Трансфекция
Трансфекция — процесс введения нуклеиновой кислоты в клетки человека и животных невирусным методом. Плазмидную ДНК наиболее часто трансфецируют в клетки, но и другие макромолекулы могут также быть введены внутрь клетки, такие как малые интерферирующие РНК, олигонуклеотиды, РНК и белки [74]. Трансфекция может состоять из нескольких стадий, но обязательным этапом является образование в плазматической мембране пор, через которые внутрь клетки способен проникать внеклеточный материал [75, 76].
Стандартный метод получения рААВ включает в себя котрансфекцию клеток рААВ плазмидой и упаковочной плазмидой, кодирующей гены Rep и белки VP (variol protein) [77]. Кроме того, клетки могут быть коинфицированы вирусом-помощником, например аденовирусом, который обеспечивает выполнение различных функций в производстве ААВ [78, 79]. Как следствие, клетки производят не только ААВ, но и аденовирусы, которые загрязняют конечный продукт (рис. 3, а).
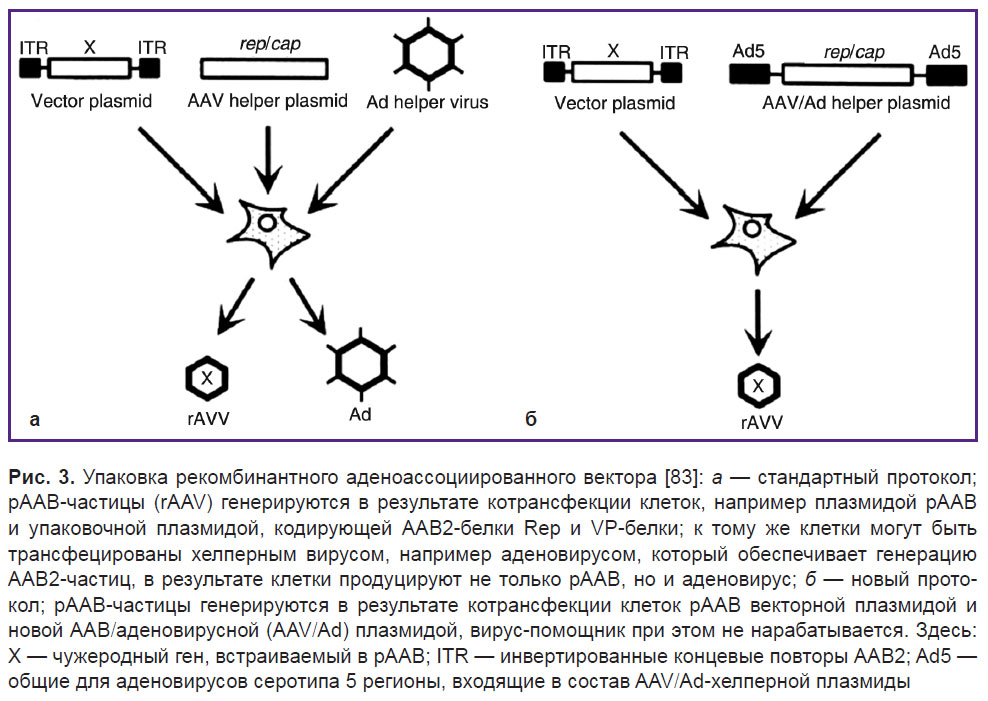 | Рис. 3. Упаковка рекомбинантного аденоассоциированного вектора [83]: а — стандартный протокол; рААВ-частицы (rAAV) генерируются в результате котрансфекции клеток, например плазмидой рААВ и упаковочной плазмидой, кодирующей ААВ2-белки Rep и VP-белки; к тому же клетки могут быть трансфецированы хелперным вирусом, например аденовирусом, который обеспечивает генерацию ААВ2-частиц, в результате клетки продуцируют не только рААВ, но и аденовирус; б — новый протокол; рААВ-частицы генерируются в результате котрансфекции клеток рААВ векторной плазмидой и новой ААВ/аденовирусной (AAV/Ad) плазмидой, вирус-помощник при этом не нарабатывается. Здесь: Х — чужеродный ген, встраиваемый в рААВ; ITR — инвертированные концевые повторы ААВ2; Ad5 — общие для аденовирусов серотипа 5 регионы, входящие в состав AAV/Ad-хелперной плазмиды |
Передовой же метод получения рААВ основан на котрансфекции клеток рААВ и хелперной плазмидой, полученной из ААВ и аденовируса [80–82]. При этом производства аденовируса не происходит (рис. 3, б) [83].
Хелперная плазмида, или плазмида-помощник, обладает одной или несколькими функциями, которые отсутствуют у дефектной плазмиды [84]. Трансформированные клетки должны быть инфицированы также вспомогательным вирусом, например аденовирусом, что обеспечивает множество необходимых преимуществ для производства рААВ [85–87].
Типичные методы производства рААВ-векторов требуют котрансфекции клеток плазмидным вектором ААВ2 и вспомогательной плазмидой (хелперной) [88].
Хелперная плазмида экспрессирует гены rep и cap, а также гены, кодирующие продукты, важные для производства ААВ2 (рис. 4). Простой котрансфекции клеток с хелперной плазмидой и ААВ2-вектором достаточно для успешной наработки рААВ [83, 89].
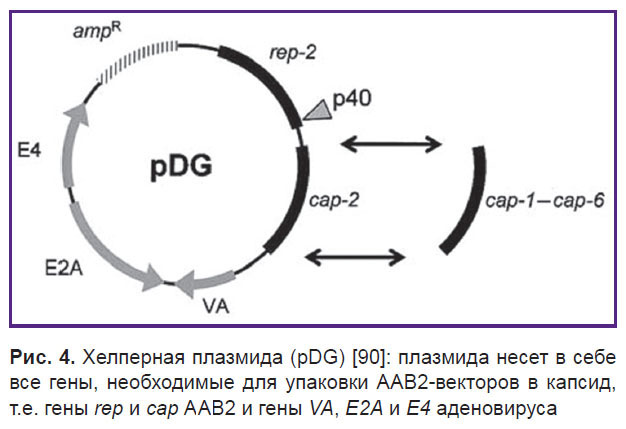 | Рис. 4. Хелперная плазмида (pDG) [90]: плазмида несет в себе все гены, необходимые для упаковки ААВ2-векторов в капсид, т.е. гены rep и cap АAВ2 и гены VA , E2A и E4 аденовируса |
Рекомбинантные векторы, полученные из ААВ2, — перспективный инструмент для генной терапии и нейробиологии, так как они являются непатогенными и могут долгосрочно экспрессироваться в различных тканях [91–93].
Основные свойства отдельных вирусных векторов, такие как размер вирусных частиц, размер генома и емкость вставки, иммуногенность, а также эффективность трансдукции и экспрессии вируса в клетках-мишенях, отражены в таблице (см. таблицу).
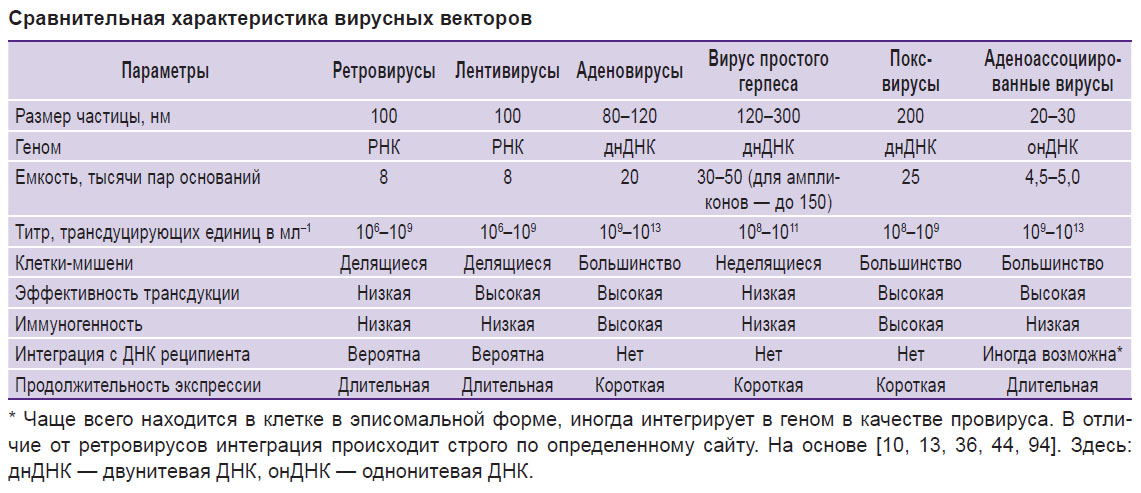 Сравнительная характеристика вирусных векторов Сравнительная характеристика вирусных векторов |
Применение генетических вирусных векторов в нейробиологии
Перенос генетической информации в клетки центральной нервной системы имеет большие перспективы для фундаментальных и клинических исследований в нейробиологии [95, 96]. Так как мозг представляет собой сложноорганизованную структуру, это делает затруднительным генетические манипуляции в нем [97]. В настоящее время вирусные векторы являются наиболее широко используемыми транспортными средствами для переноса генов в зрелые клетки мозга млекопитающих [98, 99]. Тем не менее не существует «универсального идеального вектора» и любые исследования мозга требуют использования определенных векторных систем [100–102]. Кроме того, все вирусные векторные системы имеют свои недостатки и преимущества в зависимости от выбранных клеток-мишеней и специфики каждого исследования [103]. Причем количество векторов, подходящих для фундаментальных исследований, превосходит количество тех, которые могут применяться в клинических испытаниях [104, 105]. Сейчас наиболее широко используемыми векторами в нейробиологии являются аденоассоциированные, аденовирусные, герпесвирусные и лентивирусные векторы [106].
Рекомбинантные ААВ представляют собой векторы нескольких серотипов со специфическим клеточным тропизмом. Например, AАВ2 заражает преимущественно нейроны, но не все виды нейронов заражаются одинаково хорошо. Другие серотипы, такие как ААВ4 и ААВ5, демонстрируют различный тропизм и способность к диффузии [25].
Cre-рекомбиназа в сочетании с Cre-зависимой экспрессией белков и рААВ используется для достижения экспрессии трансгена в различных нейронных популяциях. При этом Cre-зависимые векторы показали надежную способность к ретроградной инфекции и экспрессии трансгена [82].
Генетически кодируемые нейрональные сайленсеры используются для проверки участия нейрональных популяций в поведенческих функциях [107]. Например, соматостатин-экспрессирующие клетки (SST) в комплексе Бетцингера (структура заднего мозга, которая регулирует дыхание) селективно выключались, чтобы проверить их участие в дыхании [108]. В этом исследовании использовались G-белки, связывающиеся с рецепторами аллатостатина (AlstR) дрозофилы, которые могут заставить «замолчать» нейроны млекопитающих при образовании комплекса рецептор–лиганд путем активации проводимости калия. Отдельно лиганд и его рецептор, как полагают, не могут повлиять на нейроны млекопитающих. Использование рААВ2 позволило добиться специфической экспрессии AlstR в субпопуляции клеток SST.
Оценка электрической активности нейронов широко исследовалась для изучения функции нейронов, а в последнее время — для характеристики нейронных сетей. Мониторинг активности нейрона — сложная задача, которая чаще всего сводится к крупномасштабной, мультинейронной визуализации уровня кальция, отражающего электрическую активность [109]. Рекомбинантные ААВ могут доставить генетически закодированные индикаторы кальция для визуализации динамики кальция в естественных условиях с достаточными уровнями экспрессии для эффективного обнаружения. Так, рААВ-экпрессия кальциевого индикатора camgaroo-2 под контролем тетрациклинового трансактиваторного промоторного элемента была осуществлена в обонятельной луковице трансгенных мышей CaMKIIa-tTA [110]. Это вызвало экспрессию в обонятельных сенсорных аксонах и позволило контролировать динамику кальция в ответ на различные ароматические вещества.
Другой кальциевый индикатор GCaMP3 был экспрессирован в клетках моторной коры мыши с использованием рAAВ2/рААВ5, что позволило контролировать динамическую активность нескольких нейронов у бегущей мыши [111].
Также ААВ применяются для выявления и оценки синаптических связей между нейронами разных типов. К примеру, такой подход был использован, чтобы отличить проекционные модели двух смешанных нейронных популяций, которые различаются по экспрессии типов дофаминовых рецепторов 1 или 2 (D1R или D2R) [109]. Применение Cre-зависимого вирусного вектора и сильного промотора EF-1α позволило управлять GFP-трансгеном в сочетании с наличием генетической модификации в мышах, что раскрыло поразительно четкие различия стрионигральной и стриопаллидарной субстанций [111].
Ампликоны вируса простого герпеса применяются для экспрессии генов большого размера или генов с повышенной копийностью. Так, например, мутантная форма торсина А, который ответственен за развитие торсионной дистрофии и формирует витые включения в цитоплазматической мембране [112], может быть экспрессирована в культуре клеток глиомы с помощью ампликона вируса простого герпеса [113].
В лабораторной практике применяются лентивирусные векторы с синапсиновым промотором, способствующим экспрессии заданного гена в любых типах нейрональных клеток [114–117]. Также используются лентивирусные векторы с промотором, содержащим кальций-кальмодулин-зависимую протеинкиназу II альфа, с экспрессией в возбуждающих глутаматергических нейронах [118, 119]. Применяются данные векторы для оптического и электрофизиологического мониторинга их активности, а также для оптогенетической стимуляции, например при остром паркинсонизме, индуцированном посредством медикаментов.
Аденовирусные векторы также применяются в нейробиологии, например в оптогенетике. Так, лабораторией S. Kasparova был создан оптогенетический активатор, который управляет астроцитарной активностью через экспрессию разных вариантов чанелродопсина-2 (ChR2), с целью запуска внеклеточных событий, таких как внеклеточное увеличение концентрации ионов Ca 2+ [120].
Заключение
На данный момент не существует универсального «идеального» вектора, и разные исследования требуют использования определенных векторных систем. У всех вирусных векторных систем будут свои недостатки и преимущества в зависимости от выбираемых клеток-мишеней и специфики каждого исследования. В частности, преимущества рекомбинантных аденоассоциированных векторов (способность интегрировать целевой ген в геном хозяина в нужное место, что предотвращает нежелательные мутации; встраивание как в делящиеся, так и в покоящиеся клетки; широкий профиль трансдукции; низкий иммунный ответ; сильная и устойчивая экспрессия трансгена) выделяют их среди остальных вирусных векторов и делают эти векторы популярным и универсальным инструментом для доставки гена in vitro и in vivo.
Финансирование исследования. Работа выполнена при поддержке Федеральной целевой программы «Исследования и разработки по приоритетным направлениям развития научно-технологического комплекса России на 2014–2020 годы» Министерства образования и науки России, соглашение 14.581.21.0016 («Разработка методов, технологий и платформ для исследований функционирования нервных систем на основе создания высокоразрешающей информационной модели кортикальных структур мозга», уникальный идентификатор ПНИЭР RFMEFI58115X0016).
Конфликт интересов. Авторы декларируют отсутствие конфликта интересов.
- Вирусы как векторы генной инженерии
- Лентивирусные векторы: как они стали лучшими векторами для терапии ex vivo
- Лентивирусные векторы: как они стали лучшими векторами для терапии ex vivo
- Генная и клеточная терапии
- In vivo vs Ex vivo
- Лентивирусы в природе: что они собой представляют?
- Строение
- Жизненный цикл лентивирусов
- Создание лентивирусных векторов
- Безопасность превыше всего
- Рекомбинация
- Инсерционный мутагенез
- Три поколения векторов
- Производство
- Альтернатива: стабильные упаковщики
- Применение лентивирусных векторов в клинике
- Заключение и перспективы
- 🔥 Видео
Видео:Введение в генную инженерию (видео 1) | Генная инженерия |Молекулярная генетикаСкачать

Вирусы как векторы генной инженерии
Идеальный вектор для генотерапии должен быть безопасным, легко изготавливаемым, легко вносимым в подходящую целевую ткань, при этом он должен экспрессировать нужный ген пожизненно. В настоящее время нет ни одного известного вирусного или невирусного вектора, удовлетворяющего всем этим критериям.
На самом деле, вероятно, нет единственного вектора, удовлетворительного во всех отношениях для всех типов генотерапии, и потребуется набор векторов. Здесь мы кратко рассмотрим три широко используемых класса вирусных векторов, производных от ретровирусов, аденовирусов и адено-ассоциированных вирусов. Основное преимущество вирусных векторов — то, что они способны проникнуть фактически в каждую клетку в целевой популяции.
Один из наиболее широко используемых классов векторов — производные от ретровирусов, простых РНК-вирусов всего с тремя структурными генами, которые могут быть удалены и заменены нужным геном. Текущее поколение ретровирусных векторов создано так, чтобы лишить их способности к репликации.
Другие их достоинства: нетоксичны в клетке; в геном хозяина внедряется (с передаваемым геном) только небольшое количество копий вирусной ДНК; встроенная ДНК стабильна; ретровирусные векторы могут встраивать вплоть до 8 килобаз дополнительной ДНК, что достаточно для многих передаваемых генов.
Основное ограничение большинства ретровирусных векторов в том, что для интеграции вируса в ДНК хозяина целевая клетка должна делиться, а это ограничивает использование таких векторов для неделящихся клеток, например нейронов. Тем не менее ретровирусы одного класса — лентивирусы, включающие ВИЧ, способны встраивать свою ДНК во множество медленно делящихся и даже неделящихся клеток, включая нейроны. Эти векторы могут оказаться пригодными для лечения неврологических заболеваний.
Адено-ассоциированные вирусы имеют большое преимущество — они не имеют никаких неблагоприятных эффектов у больных и широко распространены в популяциях человека. Кроме того, они заражают как делящиеся, так и неделящиеся клетки и могут существовать в виде эписом или стабильно интегрироваться в хромосому хозяина.
Их основной недостаток состоит в том, что имеющиеся на настоящий момент адено-ассоциированные вирусные векторы могут встраивать не более 5 килобаз дополнительной ДНК.
Аденовирусные векторы имеют свои преимущества — их можно получать в высоком титре; они заражают множество типов клеток, как делящихся, так и неделящихся; они могут встраивать в себя от 30 до 35 килобаз ДНК. Тем не менее, помимо других ограничений, их применение недавно было связано по крайней мере с одной смертью при испытании генотерапии вследствие развития сильной иммунной реакции. Следовательно, возможность их использования в целях генотерапии в настоящее время тщательно проверяется.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Видео:Просто о генной инженерииСкачать

Лентивирусные векторы: как они стали лучшими векторами для терапии ex vivo
22 октября 2021
Видео:Клонирование ДНК и рекомбинантная ДНК (видео 4) | Генная инженерия | Молекулярная генетикаСкачать

Лентивирусные векторы: как они стали лучшими векторами для терапии ex vivo
- 964
- 0,0
- 0
- 5
Иногда самый безопасный и эффективный вариант генной терапии — не вводить вектор непосредственно пациенту, а наоборот, выделить клетки пациента, произвести с ними генно-инженерные манипуляции и ввести обратно ему же. В таком случае непревзойденный инструмент — лентивирусные векторы. Рисунок в полном размере.
Автор
Редакторы
Возникшая в конце XX века пандемия ВИЧ-инфекции и сопутствующее распространение синдрома приобретенного иммунодефицита (СПИДа) послужили толчком к масштабным исследованиям вызывающего эти патологии вируса. В этих исследованиях раскрыли детали организации генома, репликации и жизненного цикла вируса иммунодефицита человека 1, проложив тем самым путь для создания на его основе лентивирусных векторных систем. Такие системы использовались в создании самой первой одобренной CAR-T-терапии — лечения, подарившего надежду безнадежным больным, и ставшего одним из самых громких прорывов в онкогематологии за последние годы. А помогли тут во многом некоторые уникальные свойства лентивирусов, которые, как выяснилось, могут нести не только смерть, но и жизнь.
Видео:19 20 Базовые методы генной инженерииСкачать
Генная и клеточная терапии
Спецпроект о генной и клеточной терапиях, тернистом пути их развития, первых успехах и надеждах, а также о сложностях регулирования, производства и изучения этих новейших методов лечения.
Партнер спецпроекта — Департамент разработки генотерапевтических препаратов одной из крупнейших российских биотехнологических компаний — BIOCAD. BIOCAD заслужил серьезные позиции на мировом фармацевтическом рынке благодаря выпуску лекарственных препаратов на основе антител.
Со времени зарождения генной терапии — начиная с самых первых исследований и клинических испытаний — дорога к ее широкому внедрению была тернистой. Впечатляющие успехи чередовались с досадными провалами, отбросившими на новое лечение порочащую тень, что в какой-то момент резко затормозило развитие области [1].
Вы читаете пятую статью спецпроекта «Генная и клеточная терапии». Ранее мы уже информировали вас, как вообще устроены лекарства будущего [2], а также достаточно подробно останавливались на аденоассоциированных вирусах [3] как важном инструменте «генных терапевтов».
К счастью, сегодня все уже не так драматично: генная терапия стала намного безопаснее — регуляторный надзор за ней усилился, а критерии контроля качества стали строже. И все же, бросая даже беглый взгляд на ландшафт современных видов генного лечения, осознаешь, что путь в клинику для большинства таких лекарств до сих пор крайне непрост. Достаточно сравнить число запускаемых клинических исследований с количеством уже вышедших на рынок терапий — последних несоизмеримо меньше. Причин этому немало: это и вопросы безопасности и эффективности; и сложность разработки и масштабирования производства; и вопросы экономической и практической обоснованности внедрения этих совсем недешевых терапий .
Подробнее о тернистом пути разработки и производства генного лечения читайте в статье: «Генные и клеточные лекарства: сложное регулирование для сложных продуктов» [4]; ну а об экономических перипетиях при внедрении сверхдорогих инновационных лекарств (да и не только их) расскажет статья: «Фармакоэкономика: лечить или экономить?» [5].
Однако генная терапия по-прежнему более чем актуальна, ведь она предлагает регулирование молекулярных процессов на новом уровне, тем самым позволяя подбирать ключи к лечению ранее неприступных болезней.
Существующие ныне генные терапии в основном работают по принципу внедрения нужного генетического материала в определенные клетки пациента, что и позволяет модулировать происходящее в организме с лечебными целями. Поэтому для такого лечения критически важна успешная доставка требуемого гена в целевые клетки и ткани, что чаще всего осуществляют с использованием особых носителей — векторов.
Видео:Вирусы: виды, устройство и способы заражения клеткиСкачать

In vivo vs Ex vivo
В предыдущих статьях нашего цикла о генной терапии уже были довольно подробно разобраны имеющиеся ныне решения. Не будем сильно повторяться, но отметим особо важные для дальнейшего повествования моменты.
- Обозревая генную терапию, в основном имеет смысл говорить о доставке генов c применением вирусных векторов, — другие способы пока используют гораздо реже.
- В рамках такого лечения реализуют два совсем разных подхода: in vivo и ex vivo. Это во многом и определяет выбор подходящих векторов для доставки генов.
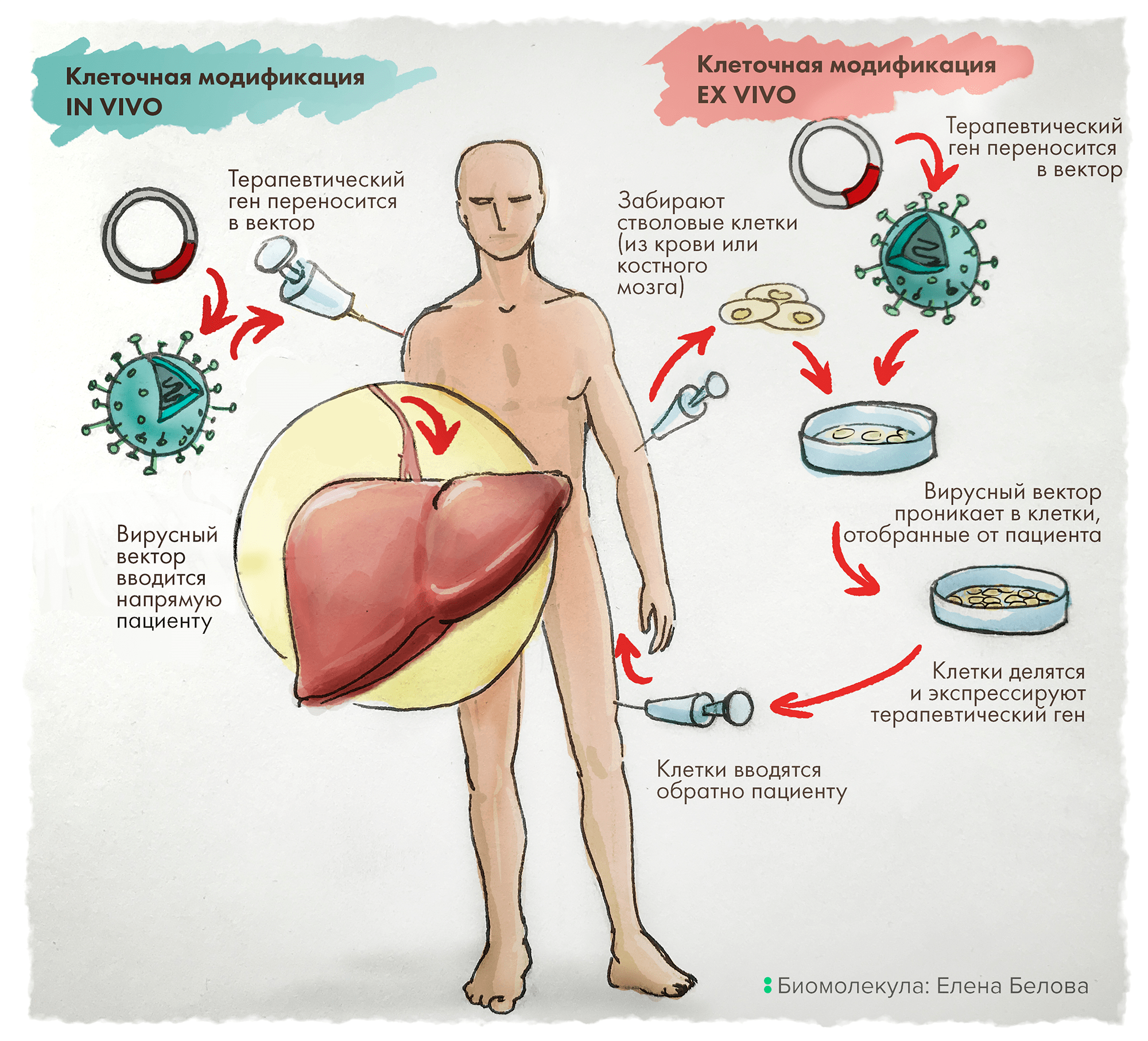
Терапия in vivo — это прямой перенос векторов в организм пациента путем внутривенной инфузии раствора, содержащего такие носители. В такой доставке наилучшим образом проявили себя аденоассоциированные векторы, поскольку имеют широкий тропизм — специфичность к различным типам клеток, а также низкий уровень генотоксичности и соответственно бóльшую безопасность [3].
Альтернативно терапевтический ген может быть доставлен ex vivo: для этого клетки сначала отбирают у пациента, генетически модифицируют и культивируют вне организма. И только после этого такие несущие целевые (читай — терапевтические) гены клетки вводят путем инфузии обратно пациенту (рис. 1) [6].
Рисунок 1. In vivo vs Ex vivo. Терапия in vivo заключается в прямой доставке в организм пациента векторов, содержащих терапевтические гены. В отличие от этого, подход ex vivo включает предварительный отбор клеток у пациента, их генетическую модификацию in vitro (это, как правило, внедрение нужного — лечебного — гена), затем отбор эффективно трансдуцированных клеток с последующим размножением и введением такой культуры клеток обратно пациенту.
Для клинических приложений терапии ex vivo изначально были особо интересны γ-ретровирусы и лентивирусы, — ведь они способны перманентно интегрировать свой генетический материал в геном клеток организма-хозяина, что подразумевает передачу генов интереса при делении в ряду клеточных поколений, а значит, низкую элиминацию и долгоиграющую экспрессию.
Однако по сравнению с γ-ретровирусными векторами лентивирусы оказались безопаснее в доклинических исследованиях, а потому сейчас преимущественно используются именно они [7]. Лентивирусные векторы способны еще и трансдуцировать как постмитотические, так и неделящиеся клетки, в то время как для эффективного инфицирования с использованием других ретровирусных платформ требуется, чтобы клетка активно делилась [6]. Дело в том, что среди всех ретровирусов только лентивирусы способны проникать через ядерную мембрану.
Серьезными плюсами лентивирусных векторов являются также относительно низкая стоимость и возможность масштабирования производства. Эта платформа была выбрана для создания одной из наиболее многообещающих ныне генных терапий ex vivo: онколечения с использованием CAR-T-клеток [8], — и используется сегодня при разработке таких препаратов наряду с γ-ретровирусами. К этому мы еще вернемся.
Видео:Изменить ДНК у себя дома? | DIY-биологияСкачать

Лентивирусы в природе: что они собой представляют?
Строение
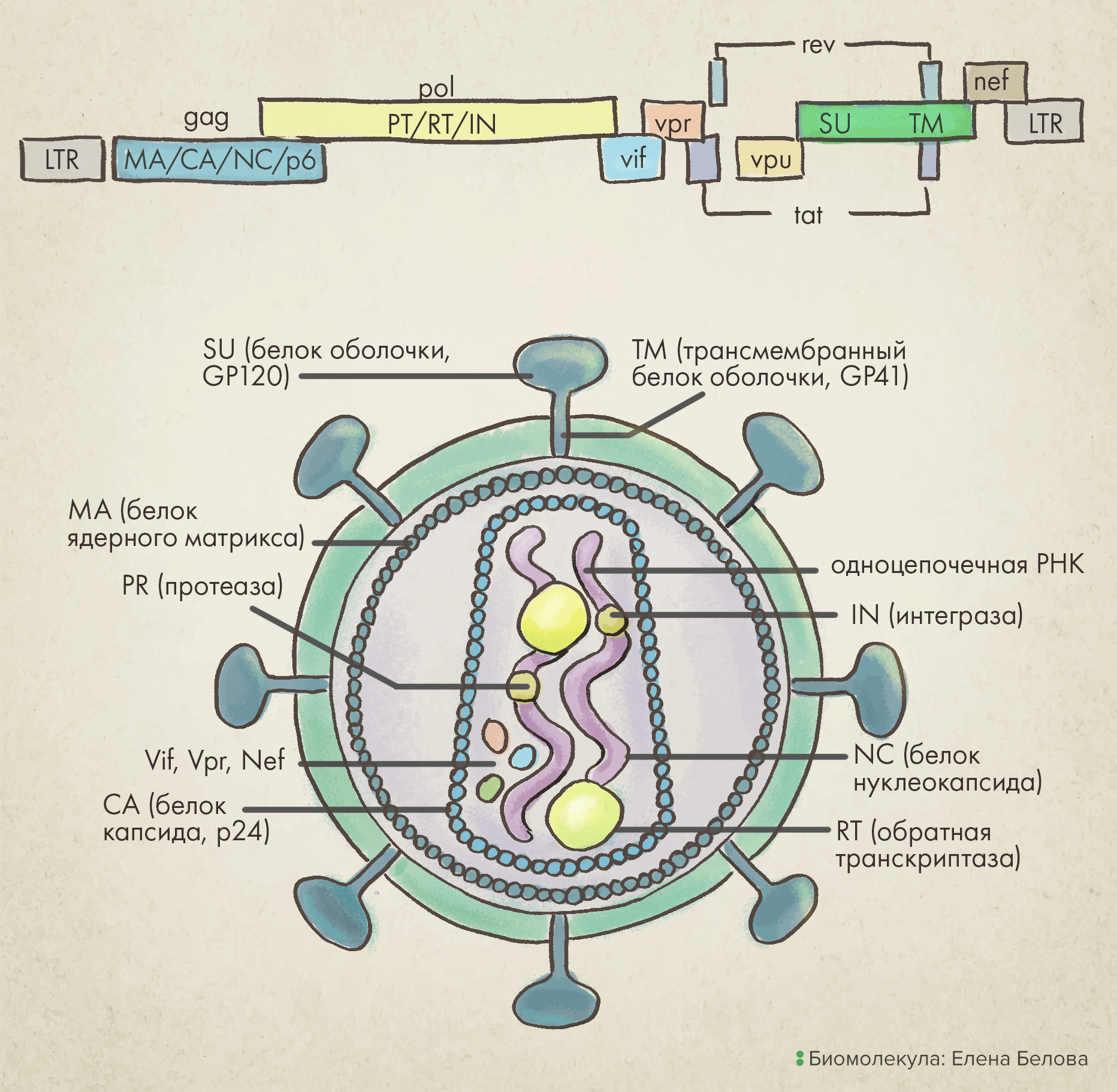
Род лентивирусов из семейства ретровирусов отличается наличием особой оболочки (суперкапсида), внутри которой заключен геном в виде положительной одноцепочечной РНК , которая после попадания вируса в клетку конвертируется в двухцепочечную ДНК. Наиболее известный их представитель — вирус иммунодефицита человека (ВИЧ) [9]. Покрывающий такие вирусы суперкапсид — сферический, слегка плеоморфный, диаметром приблизительно 80–100 нанометров. Длина его генома около 9 килобаз (тысяч пар нуклеотидных оснований), включая три основных структурных гена: gag, pol и env (рис. 2).
Под положительной (+) РНК понимают геномную нуклеиновую кислоту вируса, похожую на мРНК, благодаря чему информация в ходе трансляции — синтеза полипептидной цепи вирусного белка в зараженной клетке — может считываться непосредственно с нее. Такую (+)РНК называют также смысловой. В отличие от этого, антисмысловая (−) РНК комплементарна мРНК, и для перевода в аминокислотную цепочку ее требуется сначала реплицировать в (+)-форму с помощью фермента РНК-репликазы.
Рисунок 2. Лентивирус: геномная карта и структура вириона. Важный для проникновения в клетку ген env обозначен зеленым цветом.
Ген gag первым транскрибируется в незрелую пре-мРНК, которая затем расщепляется на отдельные транскрипты, кодирующие три белка вирусного кора:
- Матричный белок (matrix, MA) необходим для сборки вириона и инфекции неделящихся клеток.
- Капсидный белок (capsid, CA) формирует гидрофобную «сердцевину» вириона.
- Нуклеокапсидный белок (nucleocapsid, NC) накрепко связан с РНК в вирионе — он механически «укрывает» последовательность нуклеотидов, защищая тем самым вирусный геном.
Ген pol кодирует ферменты, необходимые для репликации генетического материала: вирусную протеазу (PRO), обратную транскриптазу (RT) и интегразу (IN).
Наконец, ген env кодирует белок вирусной поверхности: гликопротеин gp160, который в процессе созревания вирусной частицы расщепляется на белок поверхности вириона gp120 (SU) и трансмембранный белок gp41 (TM).
Кроме того, вирусный геном содержит регуляторные гены (tat и rev), которые после инфицирования вирионом экспрессируются первыми и нужны для ускорения продукции мРНК, а также четыре вспомогательных гена (vif, vpr, vpu, и nef) [10].
Жизненный цикл лентивирусов
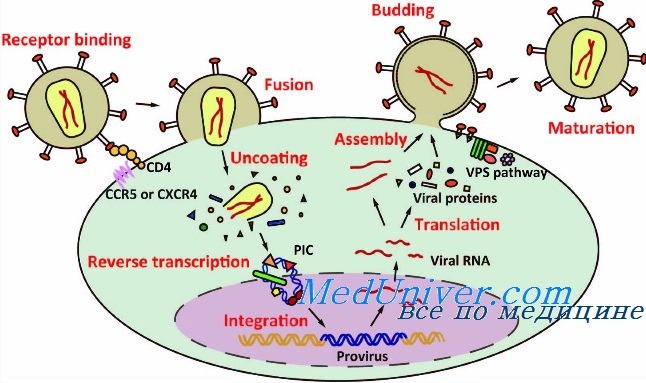
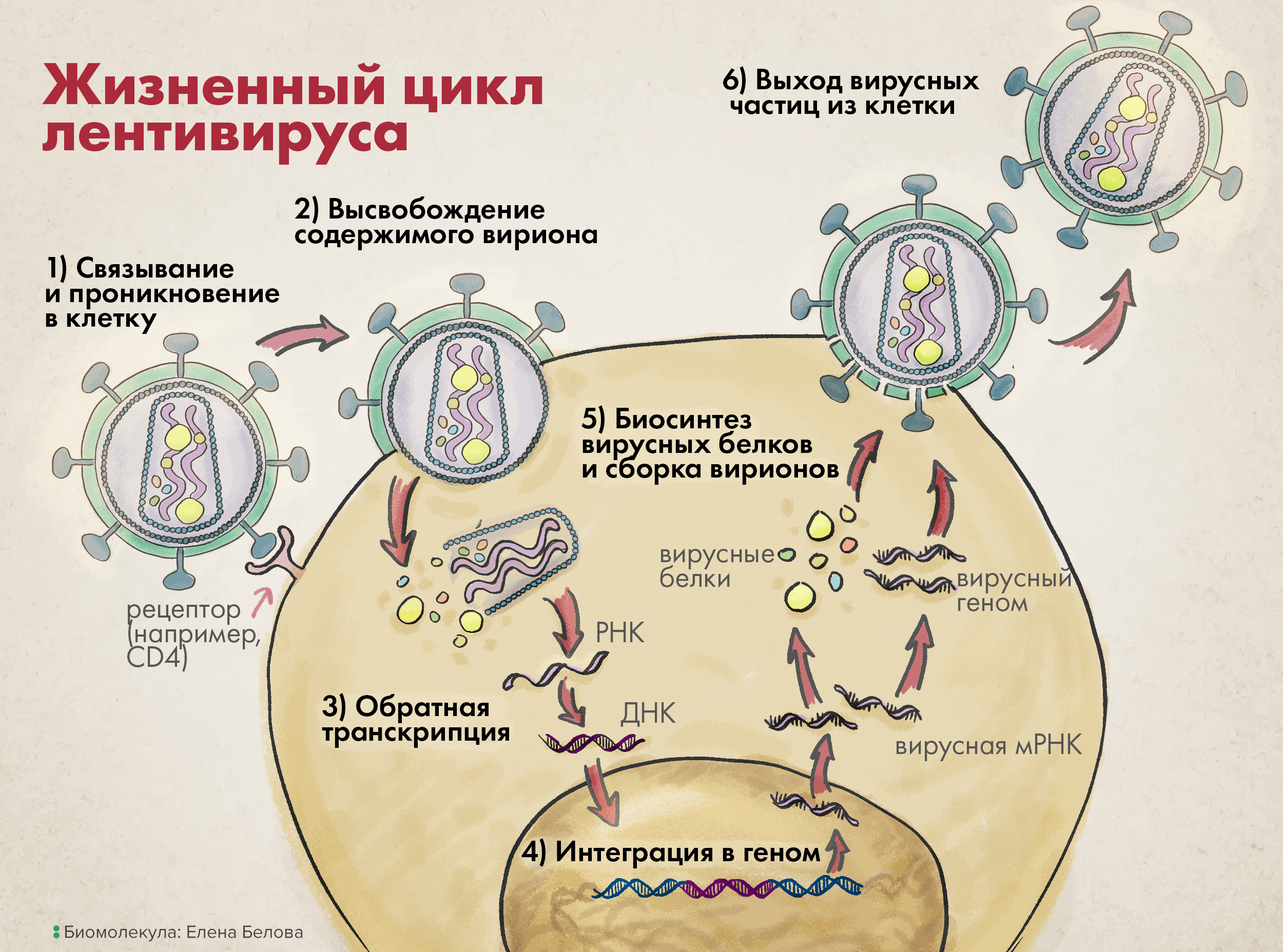
Жизненный цикл лентивируса можно немного обобщить и представить в виде шести основных шагов (рис. 3).
На первой стадии вирион связывается со своей клеткой-мишенью через взаимодействие между белком вирусной оболочки gp120 (SU) и особым рецептором клеточной поверхности.
Существование этих поверхностных и специфичных белков-рецепторов собственно и определяет особую способность вирусов инфицировать строго определенные типы клеток (известную также как тропизм).
Рисунок 3. Жизненный цикл лентивируса. 1. Связь с клеточной поверхностью и проникновение в клетку. 2. Высвобождение содержимого вириона во внутриклеточную среду. 3. Обратная транскрипция. 4. Интеграция в геном. 5. Биосинтез вирусных белков и сборка вирионов. 6. Выход вирусных частиц из клетки.
При инициации цикла заражения вирусом ВИЧ, помимо взаимодействия гликопротеина SU с первичным рецептором СD4 на поверхности лимфоцитов Т-хелперов (что и определяет патогенез ВИЧ-инфекции), происходит также его связывание с корецепторами: CXCR4 или CCR5.
Затем вирусные трансмембранные белки (TM) изменяют свою конформацию, чтобы сблизить вирион и клетку, что приводит к слиянию их мембран и проникновению вируса в клетку (этап 1 на рисунке 3).
После входа в клетку матрикс вируса — то есть все его содержимое, кроме слившегося с мембраной клетки суперкапсида, — распределяется в цитоплазме на составляющие элементы: структурные белки капсида, нуклеиновые кислоты вирусного генома, а также ферменты, необходимые для успешной репродукции генетического материала (этап 2 на рисунке 3).
Используя вирусную РНК как шаблон, а также нуклеотиды зараженной клетки, обратная транскриптаза начинает синтезировать комплементарную вирусную ДНК, а точнее — провирусную ДНК (этап 3 на рисунке 3); последняя затем импортируется в клеточное ядро, вставляясь там с использованием вирусной интегразы в геном клетки-мишени (этап 4).
Дальнейшая репродукция генетического материала идет уже как по нотам: в соответствии с центральной догмой молекулярной биологии. Из последовательности провируса в геноме транскрибируются одноцепочечные (+)РНК, затем с них транслируются вирусные белки (этап 5); они упаковывают вирусные нуклеиновые кислоты так, чтобы в одном вирионе таких последовательностей было две (этап 5).
После этого сформированные вирусные частицы, прорывая цитоплазматическую мембрану, выходят из клетки, формируя из ее фрагментов свой суперкапсид (этап 6 на рисунке 3). Ну а такие новые вирионы заражают уже другие клетки, и весь описанный цикл повторяется [10].
Видео:Генная инженерия за 4 минутыСкачать

Создание лентивирусных векторов
Теперь мы знаем, как структурно устроены лентивирусы, каков их жизненный цикл, но пока еще не разобрались, что собой представляют лентивирусные векторные системы, — как они работают и как их производят. Что же, рассмотрим и этот вопрос.
Безопасность превыше всего
Рекомбинация
Лентивирусы имеют высокую частоту рекомбинации (обмена частями генома между двумя вирусами) и быстро мутируют. Отсюда естественные опасения, что векторы на их основе смогут самопроизвольно воспроизводиться в организме человека и благодаря дальнейшей «перетасовке генов» приводить к появлению суперинфекций. Чтобы снизить подобные риски при разработке векторных систем, основные гены исходных вирусов стали распределять в отдельные плазмиды. При этом полученные векторы (уже неспособные к репликации) — далее еще и последовательно улучшали: на сегодняшний день сменилось уже три поколения таких частиц.
Инсерционный мутагенез
Помимо образования репликационно компетентного вируса, вторым основным риском при применении ретровирусных векторов является онкогенез, возникающий за счет так называемого инсерционного мутагенеза. Критически важно оценивать такие риски, ведь γ-ретровирусы имеют тенденцию встраиваться вблизи генных регуляторных последовательностей, что представляет большую опасность. В частности, в клинических исследованиях с использованием таких частиц фиксировались случаи смерти от развившегося лейкоза [11].
Именно поэтому в поле генной терапии наблюдается постепенное смещение в пользу преимущественного использования лентивирусных векторов, которые намного безопаснее [12]. Они предпочитают транскрипционно активные регионы, но интегрируются в основном в «тело гена» (преимущественно в интроны), избегая энхансеров и промоторов, — что и снижает (и довольно существенно) риски онкогенеза [11], [12].
Поскольку инсерция в транскрипционно активные регионы все же может быть генотоксичной, для усиления биобезопасности разработали так называемые самоинактивирующиеся векторы (self-inactivating, SIN). Они обладают делецией в регионе 3′-LTR вирусного генома: во время обратной транскрипции эта делеция переносится на 5′-LTR провирусной ДНК, что подавляет транскрипционную активность.
Это предотвращает продукцию полноразмерного вируса (после интеграции векторного генома в геном клетки-хозяина), минимизируя тем самым вероятность возникновения репликационно активных вирусных частиц [13]. Более того, такая делеция снижает вероятность, что клеточные кодирующие последовательности, в которые встроился вектор, будут аберрантно экспрессироваться в связи с активностью промотора или через энхансерный эффект. Наконец, дизайн SIN предотвращает потенциальную транскрипционную интерференцию между LTR и промотором, управляющим экспрессией трансгена [13].
Другая повышающая безопасность модификация заключается во включении синтетического инсулятора хроматина в лентивирусные векторы, что снижает взаимодействия между трансгеном и ближайшими к нему генами, также уменьшая возможность аберрантной экспрессии.
Кроме того, правильный подход к дозированию векторов позволяет избегать множественных интеграционных событий в клетке. В идеале требуется подобрать такую дозу, чтобы интеграция происходила в среднем один раз на клетку [12].
В совокупности, все перечисленные меры снижают риск генотоксичности, однако говорить о том, что он сведен на нет, пока еще рано. В нескольких последних исследованиях с использованием лентивирусных векторов были зафиксированы случаи возникновения онкологических заболеваний. В двух из них после проведения расследования испытания продолжили, так как вероятность связи генной терапии и онкозаболеваний посчитали пренебрежимо малой.
Для одного из случаев вопрос о взаимосвязи использования лентивирусных векторов и онкозаболеваний пока остается открытым. Наверное, и мы не будем делать поспешных выводов, ведь с одной стороны, — опасность инсерционного онкогенеза при использовании лентивирусов вполне реальна, а с другой — серьезной статистики по таким случаям нет. Кроме того, в случае очень тяжелых заболеваний, где альтернатива для пациента — постепенное ухудшение состояния и гарантированная смерть через несколько лет, небольшой риск может быть оправдан. Разумеется, ученые при этом не прекращают искать более безопасные способы модификации геномов.
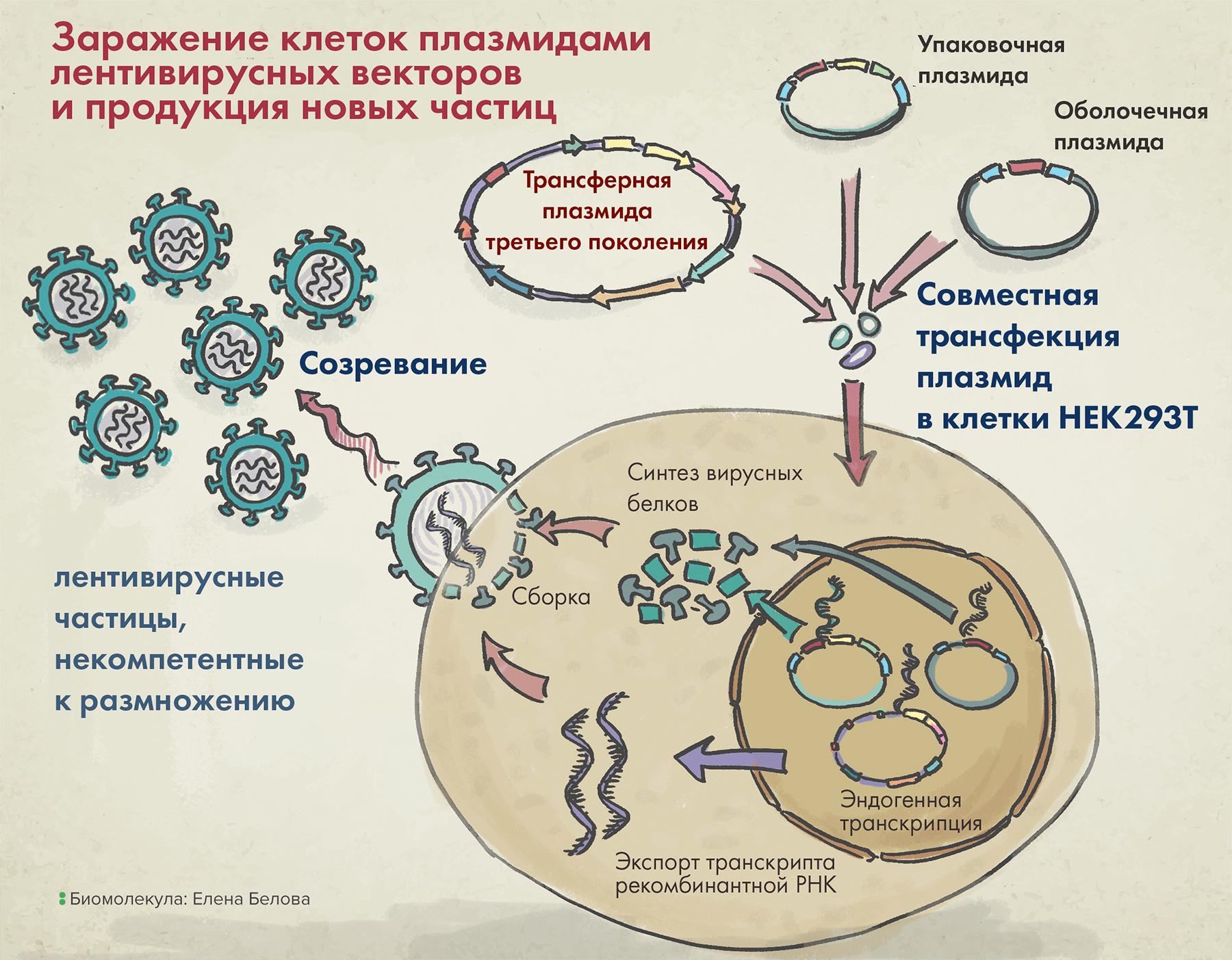
Три поколения векторов
Первые лентивирусные векторные системы содержали три плазмиды: трансферную (transfer), оболочечную (envelope), и упаковочную (packaging).
Упаковочная плазмида содержала бóльшую часть генома исходного вируса: структурные, ферментативные, регуляторные и вспомогательные последовательности, — и не включала гены, кодирующие поверхностные белки вириона. А ведь именно они нужны для связи с клеткой и проникновения в нее, что является ключевым этапом репликативного цикла. Поэтому такие векторные системы (с удаленным геном env) — к репликации уже неспособны, однако уметь проникать в клетку они ведь все же должны — иначе как же они доставят туда целевые гены?
За это отвечает оболочечная плазмида, несущая последовательность вирусного гликопротеина (такого как оболочечный гликопротеин G вируса везикулярного стоматита VSV-G) для помощи векторной частице в связывании с рецепторным белком на поверхности клетки.
Эта технология, основанная на общем свойстве большинства ретровирусов, — возможности формировать так называемые псевдотипы (частицы, в оболочку которых включается поверхностный белок какого-то другого вируса) — позволила расширить диапазон поражаемых ими клеток. Псевдотипированные белком VSV-G векторы обладают уникальными преимуществами: большей стабильностью, а также способностью связываться с рецепторами LDL (липопротеинов низкой плотности), присутствующим на поверхности множества клеток, — что и определяет широкий тропизм этих частиц [10]. Существуют и другие варианты псеводтипирования векторов, расширяющие их тропизм (табл. 1).
| Лентивирусные псевдотипы | Исходный вирус (у которого «позаимствован» поверхностный гликопротеин вирусной оболочки) | Клеточный рецептор, с которым связывается псевдотип | Клеточный тропизм | Эффективность |
|---|---|---|---|---|
| VSV-G | Вирус везикулярного стоматита | LDL-R | Широкий тропизм в не первичных (подвергнутых хотя бы одному пассивированию) культурах клеток | Высокая |
| BaEV | Эндогенный ретровирус павиана | ASCT-1 ASCT-2 | CD34+ клетки | 30% |
| Наивные Т-клетки | До 80% | |||
| Наивные В-клетки | 40% | |||
| В-клетки памяти | 20% | |||
| Натуральные киллеры | 40% | |||
| Ранние тимоциты | До 80% | |||
| RD114 | Эндогенный ретровирус кошек | ASCT-2 | Наивные Т-клетки | До 60% |
| Наивные В-клетки | До 30% | |||
| H/F | Вирус кори | SLAM CD46 | CD34+ клетки | ── |
| Покоящиеся Т-клетки памяти | ── | |||
| Наивные Т-клетки | До 50% | |||
| Покоящиеся В-клетки | ||||
| Покоящиеся гемопоэтические стволовые клетки | До 70% | |||
| Дендритные клетки | ||||
| G/F | Вирус Нипах | EphinB2/B3 | Перициты | 20–40% |
| Клетки эндотелия опухоли | ||||
| COCV | Везиколовирус Кокал | LDL-R | Стимулированные клетки CD34+ | До 80% |
Наконец, последний компонент векторной системы первого поколения — трансферная плазмида — несет целевой трансген, а также так называемую последовательность пси-петли (ψ-петли), — и все это в обрамлении длинных терминальных повторов (long terminal repeats, LTRs). Последние два элемента необходимы для упаковки вирусной РНК в вирион (рис. 4).
Рисунок 4. Упаковка лентивирусных векторов в клетке (на примере третьего поколения таких систем).
После заражения клеток тремя вышеназванными плазмидами в них происходит сборка вирусных частиц, а затем уже их выход наружу. Высвобождаемые векторы содержат VSV-G (он помогает им впоследствии проникать в клетки), но внутри них нет гена, кодирующего этот белок. Так происходит потому, что в кодирующей VSV-G плазмиде отсутствуют генетические последовательности, необходимые для сборки белковой вирусной оболочки, а значит, все ее содержимое запаковаться в вирион уже не сможет.
Поэтому такие частицы умеют доставлять гены в клетку, но не способны размножаться. Чтобы они вдруг снова научились этому, необходима рекомбинация между нашими векторами и, например, природными лентивирусами. Гипотетически это возможно, хоть и маловероятно, — ведь для восстановления репликативно компетентного генома должно многое совпасть: одновременное заражение клеток и вектором, и вирусом, а также прицельный обмен между ними генетическим материалом, — что в силу случайного характера рекомбинации вряд ли случится.
Тем не менее чтобы обезопаситься еще больше, исследователи стали менять исходный геном лентивируса еще сильнее: разбивать его на большее число плазмид, удалять еще больше нецелевых генов, а также модифицировать все необходимые в векторе нативные последовательности. Такие стратегии легли в основу создания лентивирусных векторов второго и третьего поколений (табл. 2).
| Характеристика | Второе поколение | Третье поколение |
|---|---|---|
| Количество плазмид | 3 | 4 |
| Наличие делеции в области U3 в 3′ LTR — для создания самоинактивирующегося вектора (Self-INactivation, SIN) | Нет | Да |
| 5′ LTR | Дикого типа (5′ LTR) | Химерные (RSV) |
| Количество упаковочных плазмид | 1 | 2 |
| Вспомогательные гены: vif, vpr, vpu, nef | Отсутствуют | Отсутствуют |
| tat и rev гены | В упаковочной плазмиде | Ген tat удален, rev в отдельной упаковочной плазмиде |
| gag и pol гены | В упаковочной плазмиде, вместе с tat и rev | Вместе в отдельной плазмиде |
| Псевдотипирование | Псевдотипированы (VSV-G) | Псевдотипированы (VSV-G) |
| Количество рекомбинационных событий, необходимых для генерации репликационно компетентных вирусов | 3 рекомбинации | 4 рекомбинации |
Видео:Как работает генетическая инженерия.Скачать

Производство
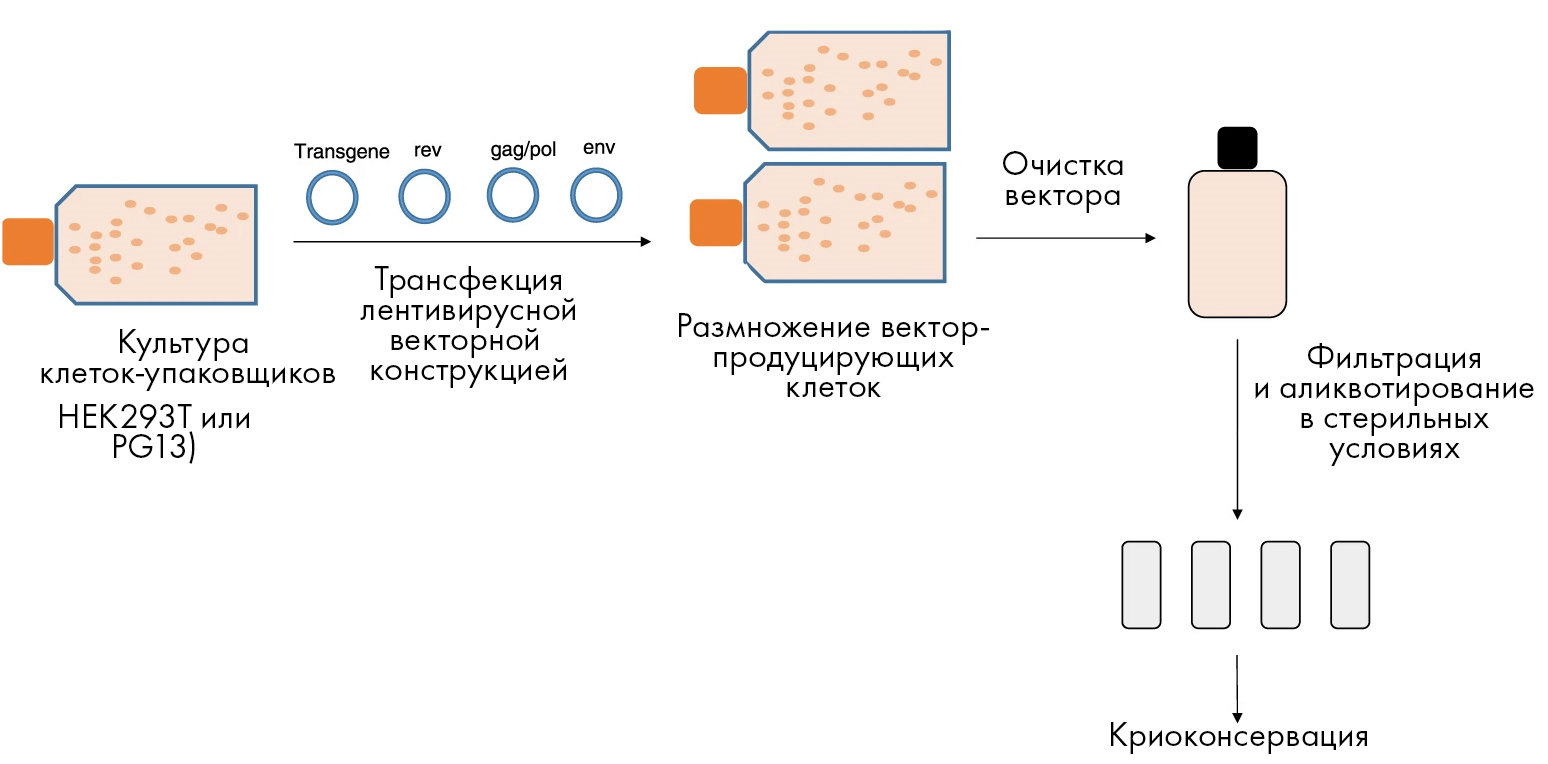
Создание эффективных векторных систем — это лишь первый этап к достаточной продукции нужного материала. Не менее важна разработка технологии производства и ее последующее масштабирование на большие объемы, — чтобы можно было получать требуемые частицы в нужных количествах. При этом в современном мире продукция вирусных частиц для лечебного применения должна идти по Правилам надлежащей производственной практики (известной также как GMP). На рисунке 5 даны основные стадии производства лентивирусных векторов.
Рисунок 5. Основные этапы продукции вирусных векторов на современном производстве, работающем в соответствии с принципами GMP. Все начинается с культуры специальных «клеток-упаковщиков» (таких как HEK293T или PG13). Эти особые упаковочные линии культивируют в течение нескольких дней, заражают плазмидами третьего поколения лентивирусного вектора, и затем уже такие вектор-продуцирующие клетки снова размножают в культуре. После этого векторы выделяют и очищают от остатков клеток (т.н. дебриса: различных клеточных органелл, плазмалеммы и т.д.), а также других загрязняющих примесей. После очистки содержащий векторы полупродукт фильтруют через мембрану с определенным размером пор, не пропускающюю микроорганизмы (что позволяет достичь стерильности). Далее полученный сток асептично распределяют по отдельным аликвотам и криоконсервируют. Сообщалось, что такие замороженные при −80 °С векторы могут сохранять свою стабильность до 9 лет после криоконсервации. Стоит также отметить, что в течение всего описанного процесса очень важен контроль качества, ведь, например, не до конца удаленный из стоков вектора клеточный дебрис может вызывать воспалительные реакции, что было показано в исследованиях как in vitro, так и in vivo [15].
Альтернатива: стабильные упаковщики
Еще один способ получать лентивирусные векторы, помимо временной трансфекции плазмидами, — создание стабильных линий клеток-упаковщиков. Для этого геном клеток (чаще всего это клетки почки человеческого эмбриона HEK293T) модифицируют так, чтобы они смогли стабильно экспрессировать бóльшую часть вирусного генетического материала.
Такие клетки-упаковщики, как правило, экспрессируют гены gag, pol и rev, а зачастую также ген капсида VSV-G. Далее для использования в качестве продуцентов векторов их нужно заразить плазмидой, несущей целевой ген.
Пока что такие стабильные линии используют реже чем «стандартные» клетки-продуценты, ─ но перспективы расширения их применения весьма заманчивы. Они могут осуществлять долгоиграющую экспрессию, что крайне желательно, ─ так как позволит упростить производство, снизив тем самым и его стоимость [16].
Видео:Софья Феоктистова. Вирусные вектора (ААВ, АВ, Ленти)Скачать

Применение лентивирусных векторов в клинике
С момента первых применений лентивирусные векторы стали одним из основных инструментов арсенала генной и клеточной терапии с заметными успехами в клинических исследованиях [17]. Одна из причин — они изначально обладали большим потенциалом благодаря способности эффективно трансдуцировать CD34 + стволовые клетки. Из последних, как известно, в процессе гемопоэза появляются все остальные типы кровяных клеток [18], а потому их генетическая модификация была крайне привлекательна. Ведь после дифференциации эти измененные клетки теоретически смогут остановить (или хотя бы притормозить) патогенез самых разных связанных с ними болезней.
Ученым и медикам оставалось лишь проверить эту теорию практикой, и вскоре перенос генов с использованием лентивирусного вектора в CD34+ стволовые клетки был осуществлен для лечения нескольких генетических заболеваний. Среди них: бета-талассемия, серповидноклеточная анемия, Х-сцепленная адренолейкодистрофия, метахроматическая лейкодистрофия, синдром Вискотта—Олдрича и др. При этом о наличии каких-либо связанных с вектором серьезных нежелательных явлениях в этих исследованиях заявлено не было (о первом тревожном сигнале, связанным с онкогенезом, рассказано выше) [15].
Ранние успехи подстегнули развитие такого лечения, и, согласно регистру клинических испытаний ClinicalTrials.gov, функциональность лентивирусного вектора сейчас уже тестируют более чем в 4000 исследований. При этом известно, что и количество подобных испытаний непрерывно и экспоненциально растет, например: в 2017 г. их было около 200, в 2020-м — более 600 [19], ну а сегодня, как видим, — уже на порядок больше. Из такого обширного поля настоящими прорывами можно назвать уже одобренное лечение, — а это пока что два генных продукта:
- Zynteglo (Bluebird bio, Массачусетс, США) для лечения бета-талассемии.
- Kymriah (Novartis, Базель, Швейцария) для лечения онкогематологических болезней [19].
Они оба представляют собой лечение ex vivo аутологичными генномодифицированными клетками крови пациентов, однако Novartis использует еще и принципиально новый (хоть и разрабатываемый немало лет) подход — внедрение генов для изменения поверхностного рецептора T-лимфоцитов. После модификации такой рецептор способен распознавать специфичные маркеры на опухолевых клетках, — ну а уже измененные T-клетки пациентов уничтожают злокачественные бласты .
Видео:Как работает генная терапия (за 5 минут)Скачать

Заключение и перспективы
Одно из направлений улучшения генной терапии — разработка новых векторов-носителей. В частности, представляют интерес не интегрирующиеся лентивирусные векторы (non-integrating lentiviral vectors, NILVs) — они привлекательны в плане снижения вероятности инсерционного мутагенеза. В них выключен фермент вирусная интеграза (как мы помним, отвечающая за внедрение провирусной последовательности в геном клетки) — и они точно так же умеют инфицировать как делящиеся, так и неделящиеся клетки. При этом вирусный геном остается в клетке в виде эписомы, а не интегрируется в геномную ДНК [15].
NILVs стабильно экспрессируют трансгены из эписомальной ДНК в неделящихся клетках, и временно — если клетки-мишени размножаются. Было показано, что такие векторы имеют широкий тропизм ко множеству различных типов клеток и тканей, что вкупе с повышенной безопасностью делает их идеальными кандидатами для использования в вакцинации и иммунотерапии.
Это также открывает перспективы использования NILVs как инструмента для доставки компонентов CRISPR/Cas9 — революционной технологии, которая ныне широко используется в исследованиях генного редактирования. Она включает так называемую направляющую РНК, помогающую распознавать нужные участки генома в клетке для связи с ними нуклеазы Cas9. Последняя начинает в этом месте расщеплять спираль ДНК, создавая двухцепочечные разрывы, которые затем могут быть репарированы определенным образом — с удалением (делецией) каких-либо «поломанных» генов, или внедрением в этом месте каких-то новых кодирующих последовательностей.
Сегодня существуют лентивирусные системы, умеющие доставлять в клетку как направляющие РНК, так и нуклеазу Cas9 (точнее кодирующие их последовательности — для последующей экспрессии).
Лентивирусные векторы также часто используют в исследовательских целях для изменения экспрессии генов посредством использования короткой шпилечной РНК или антисмысловой РНК [23], — что является частью уже известного механизма РНК-интерференции (об этом интересном феномене «Биомолекула» писала уже не раз).
Конечно, пока что большинство из таких перспективных подходов все еще находится на ранних стадиях разработки, и необходимы дальнейшие исследования, чтобы определить, насколько лентивирусные векторы по настоящему «жизнеспособны» — как инструмент для терапевтической доставки компонентов редактирования/регуляции экспрессии тех или иных генов [15].
🔥 Видео
Биология 10 класс (Урок№8 - Работы генов прокариот и эукариот. Вирусы.Генная и клеточная инженерия.)Скачать

ГМО-люди. Опыты уже начались?Скачать

Возможности генной инженерии | Лекции по биологии – биолог Александр Панчин | НаучпопСкачать

Вирусы и вакцины | РАЗБОРСкачать

Как стать бессмертным? - Генная инженерияСкачать

Вектор (молекулярная биология)Скачать

Лаборатория генной инженерии в домашних условиях: Александр Савсуненко at TEDxDonetskСкачать

1.2. Качество генной терапии: дизайн вектора и генетическая разработкаСкачать

Генная инженерияСкачать

Может ли вакцина или вирус встроиться в геном человека?Скачать