Молекулярное клонирование – это комплекс методов, направленных на создание рекомбинантных молекул ДНК, перенос их в организм-хозяина (трансформацию) и управление последующей репликацией. Молекулярное клонирование используется для изучения экспрессии интересующих генов, синтеза рекомбинантных белков, создания генно-модифицированных организмов и генной терапии.
Основные компоненты реакции молекулярного клонирования:
- Вектор для внесения целевого фрагмента в клетку-хозяина. Чаще всего в этой роли выступают плазмиды — небольшие двуцепочечные кольцевые молекулы ДНК, способные к автономной репликации. Плазмиды также содержат регуляторные элементы для управления транскрипцией и трансляцией и при сравнительно небольшом размере позволяют копировать большие участки ДНК.
- Вставка — целевой фрагмент ДНК, например ген, регуляторный элемент или оперон.
Общая схема молекулярного клонирования выглядит следующим образом:
- На первом этапе подобрают подходящую для дальнейших иследований плазмиду, а также выделяют и очищают целевой фрагмент ДНК: вырезают с помощью эндонуклеаз рестрикции, копируют методом полимеразной цепной реакции (ПЦР) или собирают из отдельных нуклеотидов. Допустим, мы хотим заставить бактерию E.coli светиться, в этом случае наш целевой фрагмент — ген зелёного флуоресцентного белка GFP.
- Далее плазмиду линеаризуют при помощи эндонуклеаз рестрикции.
- Свободные концы плазмиды и гена-вставки модифицируют, чтобы стало возможно их соединение под действием ДНК-лигазы, рекомбиназы или с помощью механизмов репарации in vivo.
- Затем сшивают плазмиду и целевой ген.
- Такую плазмиду трансформируют (вносят) в организм-хозяина. Поскольку мы внесли плазмиду с геном белка GFP, бактерия начнёт синтезировать этот белок и светиться.
На данный момент уже разработано множество методов и готовых наборов реагентов, позволяющих упростить и стандартизировать молекулярное клонирование. В этом обзоре мы рассмотрим все этапы этого сложного процесса, разберем различия в подходах к созданию ДНК-конструкций и расскажем о том какие продукты New England Biolabs (NEB) подходят для их реализации.
Итак, современный протокол молекулярного клонирования включает рестрикцию вектора и вставки, последующую очистку фрагментов и лигирование.
Затем происходит трансформация в штамм компетентных клеток для амплификации плазмиды. Успешно трансформированные колонии отбираются путем высевания на селективной среде, а затем правильность вставки проверяется методом ПЦР или рестрикционным расщеплением плазмидной ДНК.
Кроме того, для проверки целостности последовательности клонированного фрагмента нередко используют прямое секвенирование плазмиды.
Однако, способов подготовки вектора и целевого гена к вставке и их соединения существует несколько: традиционное клонирование, ПЦР клонирование, бесшовное клонирование, безлигазное клонирование и рекомбинантное клонирование.
Традиционное клонирование и ферментативная рестрикция
Под термином «традиционное клонирование» обычно подразумевают методы, в которых для синтеза рекомбинантной плазмиды используют эндонуклеазы рестрикции и лигазы.
Вставку и вектор обрабатывают рестрикционными ферментами, чьи сайты узнавания фланкируют клонируемый участок и присутствуют в полилинкере вектора. Полилинкер или сайт множественного клонирования — это участок плазмиды, содержащий большое количество сайтов рестрикции. Необходимо подбирать сайты рестрикции, уникальные как для вставки, так и для вектора.
При направленном клонировании используют две разные рестриктазы с соответствующими уникальными сайтами узнавания на концах вставки.
В зависимости от типа фермента могут образовываться тупые или липкие концы ДНК. Проводить рестрикцию сразу двумя или более ферментами гораздо проще и быстрее, особенно, если все они максимально активны в одном и том же буфере.
New England Biolabs поставляет 286 эндонуклеаз рестрикции, из них 216 имеют 100% активность в буфере CutSmart. Кроме того, почти все из них имеют статус Time-Saver. Проводить модификацию концов ДНК в этом случае не обязательно. Однако, при ненаправленном клонировании рекомендуется дефосфорилировать вектор, для исключения самолигирования.
Для объединения вектора и вставки в классическом протоколе принято использовать Т4 ДНК-лигазу. С её помощью можно провести реакцию лигирования за 2 часа при 25°С. Или сократить время реакции до 5 минут, воспользовавшись набором для быстрого лигирования от NEB.
- Набор для сборки ДНК-конструкций BioBrick
- Набор для ПЦР-клонирования
- Важнейшие методы молекулярной биологии и генной инженерии
- Важнейшие методы молекулярной биологии и генной инженерии
- «Био/мол/текст»-2011
- Введение
- Строение ДНК
- Центральная догма молекулярной биологии
- Разрезание и сшивание
- Рестрикционные эндонуклеазы
- ДНК-лигазы
- Разделение молекул ДНК: электрофорез в геле
- Выявление определенной последовательности ДНК в смеси. Саузерн блоттинг
- Клонирование ДНК
- Репликация в бактериях
- Полимеразная цепная реакция (ПЦР)
- Естественные клеточные процессы in vitro
- Секвенирование ДНК
- In vitro-мутагенез
- Системная РНК-интерференция
- Изучение экспрессии генов: ДНК-микрочипы
- Лигирование днк с вектором
- Молекулярное клонирование
- Видео генетика клонирования ДНК
- 💥 Видео
Набор для сборки ДНК-конструкций BioBrick
Технология BioBrick была одной из первых попыток стандартизировать традиционное клонирование, а теперь она признана стандартом синтетической биологии.
Готовый набор подходит для сборки мультифрагментных вставок (две вставки и один вектор) методом рестрикции/лигирования и включает все необходимые ферменты и буферы.
Схема эксперимента представлена на рисунке ниже:
Изначально процесс получения целевого участка ДНК был крайне длительным и трудоёмким, однако открытие метода полимеразной цепной реакции (ПЦР) в 1980-х годах значительно расширило возможности молекулярного клонирования. С помощью ПЦР и вставка, и даже вектор могут быть полностью синтезированы без использования рестриктаз. ПЦР клонирование — это быстрый и высокопроизводительный метод, позволяющий копировать фрагменты ДНК, которые сложно выделить в большом количестве, а также когда полная последовательность фрагмента не известна заранее.
В зависимости от свойств выбранной полимеразы, протокол может меняться. Если для амплификации используется Taq ДНК-полимераза, то благодаря нематричной активности фермента, на 3’- концах продуктов ПЦР добавляется по одному дополнительному остатку аденина. Затем такие вставки с «А-хвостами» лигируют с комплементарным вектором с «Т-хвостами» на концах, с помощью Т4 ДНК-лигазы. Такой метод называют A/T – клонирование.
При использовании современных высокоточных полимераз, например, ДНК-полимеразы Q5 дополнительных нематричных хвостов не образуется. Фрагменты с тупыми концами присоединяются стандартным лигированием или с помощью «активированного» вектора – к нему ковалентно присоединен фермент, облегчающий образование комплекса вектор-вставка, как правило используют топоизомеразу I.
Типичный недостаток ПЦР клонирования – необходимость использовать специализированные векторы. Обычно их необходимо приобретать дополнительно, например, NEB поставляет их уже в линеаризованном виде, готовом к использованию. Это также ограничивает исследователей в выборе генов устойчивости к антибиотикам, промоторов и других регуляторных элементов.
Набор для ПЦР-клонирования
Набор подходит для быстрого клонирования ампликонов, вне зависимости от вида выбранной полимеразы. При использовании набора нет необходимости очищать ПЦР-продукты перед лигированием. Для снижения количества колоний, не прошедших трансформацию разработан метод ПЦР-клонирования с векторами «самоубийцами», включающими так называемый «токсичный» ген. Если целевая последовательность корректно лигировалась, такой «токсичный» ген деактивируется и плазмида успешно амплифицируется после трансформации в клетки.
Данный набор содержит готовую смесь ферментов для клонирования, линеаризованный вектор с «токсичным» геном, компетентные клетки и питательную среду для них.
Преимущества набора для ПЦР-клонирования:
- Простое клонирование всех ПЦР-продуктов, включая фрагменты с тупыми или T/A концами;
- Быстрый протокол, лигирование всего за 5 минут;
- Упрощённый процесс отбора колоний с плазмидами;
- Не требуются этапы очистки;
- Транскрипция in vitro возможно с SP6 или T7 промоторов;
- В состав набора входят праймеры, позвояющие проводить ПЦР-скрининг колоний (colony PCR) или секвенирование;
- Все необходимые компоненты входят в состав набора.
Синтетическая биология
В 21 веке бурное развитие получило направление синтетической биологии. Методы молекулярного клонирования были усовершенствованы для создания сложных генетических конструкций с новыми заданными свойствами и не имеющих аналогов в природе. Появились новые высокопроизводительные технологии, такие как бесшовное клонирование, безлигазное и рекомбинантное клонирование и др.
Безлигазное клонирование (от англ. Ligation Independent Cloning, LIC) появилось в начале 1990-х годов. Суть метода заключается в линеаризации вектора рестриктазой и последующей обработкой ДНК-полимеразой Т4.
Метод использует 3 ’-> 5’ экзоактивность этого фермента для создания липких концов длиной 11 — 14 оснований. Включение дГТФ в реакцию ограничивает процессинг до первого комплементарного остатка цитозина, затем полимеризационная и экзонуклеазная активности ДНК-полимеразы Т4 становятся «сбалансированными».
Вставку синтезируют с помощью ПЦР, причём праймеры подбираются так, чтобы концы фрагмента были комплементарны концам вектора. Достаточно смешать такой продукт с вектором и трансформировать смесью компетентные клетки бактерии, чтобы получить плазмиды с геном интересующего белка.
На соединенных фрагментах образуются 4 ника, которые восстанавливаются репарационными системами E.coli после трансформации. Таким образом, LIC позволяет избежать нескольких стадий рестрикции, выделения из геля и лигирования, каждая из которых может стать причиной неудачного клонирования.
Технология рекомбинантного клонирования построена на основе механизма интеграции фага λ. Она получила свое название от сайт-специфического фермента рекомбиназы, благодаря которому возможно направленно переносить фрагмент ДНК из одной векторной молекулы в другую. Cre-рекомбиназа взаимодействует только с идентичными LoxP-сайтами и осуществляет вырезки или инверсии ДНК между ними, поэтому этот метод особенно удобен, когда одну и ту же вставку необходимо переместить в разные векторы с сохранением рамки считывания.
Рекомбинантное клонирование стало полезным инструментом для поиска наиболее производительных линий при экспрессии белков и при создании репортерных векторов в функциональном анализе.
Преимущества рекомбинантного клонирования:
- Быстрый протокол клонирования;
- Высокая эффективность;
- Универсальность;
- Воспроизводимость результатов.
«Швы» — это следы использования молекулярных систем клонирования. Например, в конечном продукте рекомбинантного клонирования целевые последовательности будут разделены дополнительными сайтами узнавания (LoxP). В сборке BioBrick между вставками будут оставаться участок кодирующий тирозин и стоп-кодон. «Бесшовные» методы клонирования, такие как сборка по Гибсону и технология GoldenGate, позволяют синтезировать множественные упорядоченные вставки внутри открытой рамки считывания, благодаря чему они получили широкое распространение в белковой инженерии.
Сборка по Гибсону и NEBuilder
Ставший классическим, метод сборки ДНК-конструкций по Гибсону позволяет направленно объединить до 15 фрагментов ДНК в одной изотермической реакции. Сегодня методика широко применяется благодаря своей простоте и адаптивности.
Для проведения реакции необходима смесь из трёх ферментов:
- 5’-экзонуклеаза удаляет основания с 5’- концов двуцепочечных фрагментов ДНК. Образуются выступающие липкие концы, которые гибридизуются при постепенном охлаждении реакционной смеси, объединяя фрагменты друг с другом;
- ДНК-полимераза закрывает пропуски;
- ДНК-лигаза ковалентно сшивает фрагменты ДНК.
Готовые наборы для сборки ДНК-конструкций и клонирования
Для синтеза сборок по Гибсону из 5 фрагментов используют одноэтапный короткий протокол, а при увеличении их количества — двухэтапный.
Для преодоления этих неудобств компания New England Biolabs разработала более совершенный метод сборки больших конструкций ДНК NEBuilder.
- Бесшовная сборка за 60 минут;
- В набор включены компетентные клетки NEB® 5-альфа E.coli.
- Бесшовная сборка за 15 минут;
- Единый протокол для любого количества фрагментов;
- Удаляет 5’ и 3’ ошибки спаривания нуклеотидов;
- В набор включены компетентные клетки NEB® 5-альфа E.coli.
- Подходит для сборок длиннее 15 kb;
- Бесшовная сборка за 15 минут;
- Единый протокол для любого количества фрагментов;
- Удаляет 5’ и 3’ ошибки спаривания нуклеотидов;
- В набор включены компетентные клетки NEB® 10-бета E.coli.
Готовые наборы включают сбалансированную смесь ферментов, вектор для клонирования и компетентные клетки для трансформации.
Наборы NEBuilder HiFi могут применяться для различных видов сборок:
Метод Golden Gate
Технология Golden Gate позволяет синтезировать множественные упорядоченные вставки ДНК с помощью эндонуклеаз II типа и ДНК-лигазы бактериофага T4. Рестриктазы II типа способны разрезать ДНК на определённом расстоянии от сайта узнавания и, таким образом, создавать непалиндромные липкие концы. Благодаря возможности получить любой из 256 различных вариантов липких концов длиной 4 п.о. становится возможной сборка молекулы ДНК из большого количества фрагментов.
New England Biolabs предлагает два готовых набора для клонирования методом Golden Gate: с рестриктазой BsmBI-v2 и с рестриктазой BsaI-HFv2.
Сравнение методов клонирования
| Метод | Преимущества | Недостатки |
|---|---|---|
| Традиционное клонирование | • Бюджетный; • Универсальный; • Удобен для направленного клонирования. | • Возможны ограничения, связанные с наличием сайта рестрикции |
| ПЦР- клонирование | • Высокая эффективность трансфекции; • Быстрый протокол. | • Ограниченный выбор векторов; • Стоимость выше, по сравнению с традиционным клонированием; • Отсутствие контроля последовательности на стыке; • Сложно реализовать направленное клонирование и клонирование нескольких фрагментов. |
| Бесшовное клонирование | • Не зависит от нуклеотидной последовательности вставки; • Быстрая сборка мультифрагментных конструкций; • Совершенный контроль направленности сборки. | • Высокая стоимость; • Необходимо подбирать и заказывать уникальные праймеры для синтеза вставки |
| Безлигазное клонирование | • Бюджетный; • Совместим с большим выбором векторов. | • Сиквенс-зависимый метод клонирования |
| Рекомбинантное клонирование | • Подходит для высокопроизводительного синтеза векторов | • Высокая стоимость; • Необходимо приобретать патентованные смеси ферментов. |
Онлайн-инструменты от NEB
Мы собрали для вас несколько удобных онлайн-инструментов для планирования эксперимента по клонированию, чтобы ими воспользоваться просто перейдите по ссылке.
 | NEBCutter Онлайн-инструмент для поиска сайтов рестрикции в заданной последовательности |
 | Double Digest Finder Онлайн-инструмент для подбора буферов для двойной рестрикции |
 | Enzyme Finder Онлайн-инструмент для подбора рестриктаз по названию, последовательности и др. |
 | REBASE База данных эндонуклеаз рестрикции |
Дизайн эксперимента по клонированию
- Выбрать метод клонирования в зависимости от задач и возможностей.
- Выбрать подходящие векторы, эндонуклеазы рестрикции (если требуются).
- Определиться с типом компетентных клеток и способом трансформации.
- Подобрать способ селекции клонов с наличием желаемой плазмиды.
- Выбрать способ выделения и анализа рекомбинантной ДНК.
Трансформация
Трансформация — это процесс, при котором организм приобретает экзогенную ДНК. Процесс трансформации может происходить двумя способами: естественным и искусственным.
Существует широкий спектр методов для индукции поглощения экзогенной ДНК, т. е. повышения компетентности клеток. Самый распространенный способ заключается в использовании двухвалентных катионов (например, хлорида кальция) для увеличения проницаемости мембраны бактерий, что делает их химически компетентными. Еще один искусственный метод трансформации — электропорация, при которой на клетки воздействуют электрическим током, чтобы создать отверстия в бактериальной мембране.
Правильный выбор компетентных клеток, подходящих под конкретные задачи исследователя, крайне важен для успешного клонирования. New England Biolabs поставляет несколько видов хемо- и электрокомпетентных клеток, позволяющих наработать большое количество целевой ДНК за короткое время
- Универсальные;
- Широкий выбор форматов поставки.
- Быстрый рост ( Выделение и очистка ДНК
Для большинства процессов в молекулярном клонировании крайне важны качественное выделение и высокая степень очистки нуклеиновых кислот.
До начала клонирования необходимо выделить геномную ДНК для рестрикции целевой последовательности. Затем очистить НК от остатков различных ферментативных реакций. После трансформации клеток выделить уже рекомбинантные плазмиды.
Линейка продуктов Monarch от New England Biolabs включает реагенты и расходные материалы для быстрого колоночного выделения и очистки ДНК без потери качества образца.
Набор Monarch® для выделения геномной ДНК
Выделение и очистка геномной ДНК из клеточных культур, крови, тканей и других типов образцов.
- Сбалансированная буферная система позволяет получать высокий выход НК из широкого спектра образцов;
- Пиковая длина выделенных фрагментов >50 kb;
- РНКаза А и Протеиназа К включены в набор.
Набор Monarch® для выделения плазмидной ДНК
Выделение до 20 мкг плазмидной ДНК из бактерий.
- Объем элюции всего 30 мкл;
- Включает цветные буферы для визуального контроля;
- Метод не требует добавления РНКаз.
Набор Monarch® для очистки ДНК-продуктов ПЦР и ферментативных реакций
Выделение и концентрирование до 5 мкг ДНК из ферментативных реакций
- Объем элюции всего 6 мкл;
- Конструкция колонки обеспечивает полное вымывание буфера из образца;
- Простая модификация протокола позволяет удалять олигонуклеотиды и короткие фрагменты ДНК.
Видео:Молекулярная биология - Элементы клонирования (рестрикция, электрофорез, лигирование)Скачать

Важнейшие методы молекулярной биологии и генной инженерии
27 октября 2011
Видео:CTRL+V для ДНК: рестрикция и лигирование. Курс "ГМО: технологии создания и применение"Скачать

Важнейшие методы молекулярной биологии и генной инженерии
- 47913
- 29,9
- 9
- 58
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Биология — самая быстро развивающаяся наука во второй половине ХХ и ХХI веке. Связано это, в первую очередь, с появлением нового ее раздела — молекулярной биологии, подоплекой возникновения которой, в свою очередь, стало стремительное развитие физики, химии и физико-химических методов. Я расскажу о важнейших (на мой взгляд) методах молекулярной биологии, с помощью которых были сделаны многие открытия, известные не только в узких научных кругах, но и среди широкой публики. Они принесли множество Нобелевских премий как тем, кто их открыл, так и тем, кто их использовал. Многие из них применяются не только в биологии, но и в других областях: медицине, криминалистике, археологии.
Видео:Клонирование ДНК - как и зачем это делаютСкачать

«Био/мол/текст»-2011
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2011 в номинации «Лучшая обзорная статья».
Видео:Клонирование ДНК и рекомбинантная ДНК (видео 4) | Генная инженерия | Молекулярная генетикаСкачать

Введение
Строение ДНК
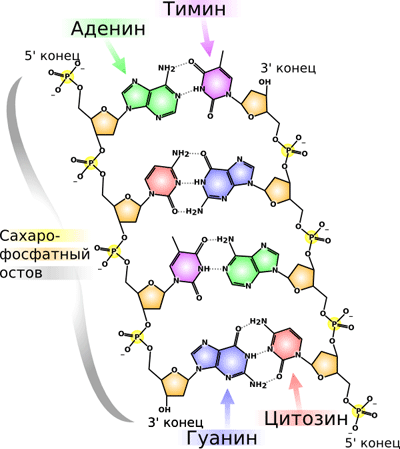
Началом молекулярной биологии принято считать открытие структуры ДНК (рис. 1) в 1953 году Джеймсом Уотсоном и Френсисом Криком, за что они (совместно с Морисом Уилкинсом) в 1962 году получили Нобелевскую премию по физиологии и медицине [1], [2]. Они выяснили, что молекула ДНК представляет из себя две противоположно направленные цепочки полинуклеотидов, закрученных вокруг общей оси в двойную спираль, причем друг напротив друга в спирали всегда стоят определенные азотистые основания: напротив гуанина (Г или G) — цитозин (Ц или C), а напротив аденина (А) — тимин (Т) (рис. 1). Это называют правилом комплементарости: цепи удерживаются вместе за счет водородных связей, возникающих между нуклеотидами. Водородная связь гораздо слабее ковалентной, с помощью которой нуклеотидные остатки соединяются между собой в одной цепи ДНК, формируя так называемый сахаро-фосфатный остов. Его так называют, поскольку в нем остатки сахара (дезоксирибозы) в нуклеотидах связаны друг с другом через остатки ортофосфорной кислоты — фосфаты. Концы обеих цепей не равноценны: по порядковому номеру атома углерода в остатке сахара один из них называют 3´, а другой — 5´. Синтез ДНК (как и РНК) в природе, как правило, идет от 5´ к 3´-концу.
Возможно, следовало бы начать отсчет с экспериментов Бидла, Татума, Ледерберга, но это дело вкуса. — Ред.
Рисунок 1. Схема строения двуцепочечной молекулы ДНК.
Однако ДНК не обязательно бывает двуцепочечной — иногда встречаются и одноцепочечные молекулы (например, в геномах некоторых вирусов). Это очень важно, поскольку, как будет рассказано ниже, двуцепочечные молекулы могут денатурировать на одноцепочечные, и, наоборот, одноцепочечные образовывать двуцепочечные.
Строение РНК аналогично (хотя обычно она состоит из одной цепи и часто образует комплементарные взаимодействия между участками одной молекулы), только вместо тимина в ее состав входит урацил, а вместо дезоксирибозы — рибоза. Подробнее обо всем этом написано в учебниках по молекулярной биологии [3].
Центральная догма молекулярной биологии
Я кратко напомню так называемую центральную догму молекулярной биологии, в первоначальном виде сформулированную Фрэнсисом Криком [4]. В общем случае она гласит, что генетическая информация при реализации передается от нуклеиновых кислот к белку, но не наоборот. А точнее, возможно передача ДНК → ДНК (репликация), ДНК → РНК (транскрипция) и РНК → белок (трансляция). Так же существуют значительно реже реализуемые пути, свойственные некоторым вирусам: РНК → ДНК (обратная транскрипция) и РНК → РНК (репликация РНК). Также напомню, что белки состоят из аминокислотных остатков, последовательность которых закодирована в генетическом коде организма: три нуклеотида (их называют кодон, или триплет) кодируют одну аминокислоту, причем одну и ту же аминокислоту может кодировать несколько кодонов.
Во второй половине XX века получили развитие технологии рекомбинантной ДНК (то есть, методы манипуляции ДНК, позволяющие различными способами изменять последовательность и состав нуклеотидов в молекуле). Именно на их основе происходит развитие всех молекулярно-биологических методов и поныне, хотя они стали значительно сложнее, как идейно, так и технологически. Именно молекулярная биология вызвала такой бурный рост количества биологической информации за последние полвека.
Я расскажу о методах манипуляции и изучения ДНК и РНК, совсем немного коснусь белков, поскольку в основном методы, связанные с ними, ближе к биохимии, чем к молекулярной биологии (хотя грань между ними в последнее время стала очень расплывчатой).
Видео:Вектор (молекулярная биология)Скачать

Разрезание и сшивание
Ферменты — белки, ускоряющие прохождение химических реакций. Они очень эффективны: ускорение может составлять несколько порядков! Например, фермент каталаза, расщепляющий перекись водорода, ускоряет реакцию примерно на 12 порядков, то есть в триллион раз! В то же время неорганический катализатор — мелкодисперсная платина — ускоряет эту же реакцию только на шесть порядков, или в миллион раз. Однако за это приходится платить очень строгими условиями работы большинства из них.
Рестрикционные эндонуклеазы
Рисунок 2. Сайты рестрикции. Сверху — целевая последовательность рестриктазы SmaI, при работе которой образуются «тупые» концы. Снизу — целевая последовательность рестриктазы EcoRI, при работе которой образуются «липкие» концы.
Одним из первых и важнейших из шагов молекулярной биологии стала возможность разрезать молекулы ДНК, причем в строго определенных местах [3]. Этот метод был изобретен при изучении в 1950—1970-е годы такого феномена: некоторые виды бактерий при добавлении в среду чужеродной ДНК разрушали ее, в то время, как их собственная ДНК оставалась невредимой. Оказалось, что они для этого используют ферменты, позднее названные рестрикционными нуклеазами или рестриктазами. Существует множество видов рестриктаз: к 2007-му году их было известно более 3000 [5]. Важным свойством каждого подобного фермента является его способность разрезать строго определенную — целевую — последовательность нуклеотидов ДНК (рис. 2). Рестриктазы не воздействуют на собственную ДНК клетки, поскольку нуклеотиды в целевых последовательностях модифицированы так, что рестриктаза не может с ними работать. (Правда, иногда, наоборот, они могут разрезать только модифицированные последовательности — для борьбы с теми, кто модифицирует ДНК, защищаясь от вышеописанных рестриктаз.) Из-за того, что целевые последовательности бывают различной длины, частота встречаемости их в молекулах ДНК варьирует: чем длиннее необходимый фрагмент, тем меньше вероятность его появления. Соответственно, образующиеся при обработке различными рестриктазами фрагменты ДНК будут иметь различную длину.
Новые эндонуклеазы продолжают открывать и по сей день. Многие из них до сих пор не клонированы, то есть, не известны гены, которые их кодируют, и в качестве «фермента» используют некую очищенную фракцию белков, обладающую нужной каталитической активностью. Новосибирская компания СибЭнзим долгое время успешно соревновалась с компанией New England Biolabs — признанным во всем мире лидером по поставке рестритаз (то есть предлагала такое же или большее различных рестриктаз, некоторые из которых весьма экзотичны). — Ред.
За выделение первой рестриктазы, изучение ее свойств и первое применение для картирования хромосом Вернер Арбер (Werner Arber), Дэн Натанс (Dan Nathans) и Гамильтон Смит (Hamilton Smith) в 1978 году получили Нобелевскую премию по физиологии и медицине.
ДНК-лигазы
Для создания новых молекул ДНК, разумеется, кроме разрезания, необходима еще и возможность сшивания двух цепей. Это делают с помощью ферментов, называемых ДНК-лигазами, которые сшивают сахаро-фосфатный остов двух цепей ДНК. Поскольку по химическому строению ДНК не отличается у разных организмов, можно сшивать ДНК из любых источников, и клетка не сможет отличить полученную молекулу от своей собственной ДНК.
Видео:Схема клонирования ДНКСкачать

Разделение молекул ДНК: электрофорез в геле
Часто приходится иметь дело со смесью молекул ДНК разной длины. Например, при обработке химически выделенной из организма ДНК рестриктазами как раз получится смесь фрагментов ДНК, причем их длины будут различаться.
Поскольку любая молекула ДНК в водном растворе отрицательно заряжена, появляется возможность разделить смесь фрагментов ДНК различных размеров по их длине с помощью электрофореза [3], [6]. ДНК помещают в гель (обычно, агарозный для относительно длинных и сильно отличающихся молекул или полиакриламидный для электрофореза с высоким разрешением), который помещают в постоянное электрическое поле. Из-за этого молекулы ДНК будут двигаться к положительному электроду (аноду), причем их скорости будут зависеть от длины молекулы: чем она длиннее, тем сильнее ей мешает двигаться гель и, соответственно, тем ниже скорость. После электрофореза смеси фрагментов разных длин в геле образуют полосы, соответствующие фрагментам одной и той же длины. С помощью маркеров (смесей фрагментов ДНК известных длин) можно установить длину молекул в образце (рис. 3).
Рисунок 3. Схема проведения электрофореза ДНК в агарозном геле.
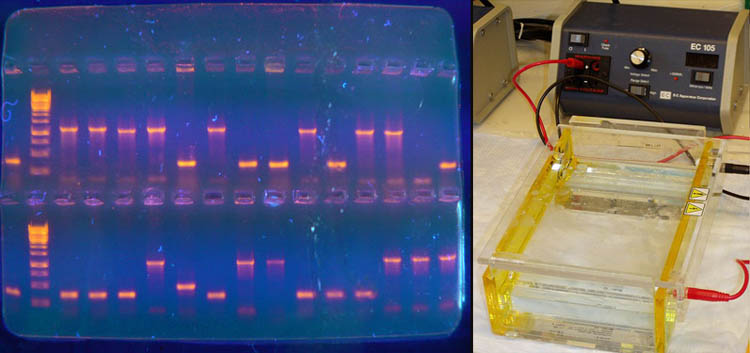
Визуализовать результаты фореза можно двумя способами. Первый, наиболее часто используемый в последнее время — добавление в гель веществ, флуоресцирующих в присутствии ДНК (традиционно использовался довольно токсичный бромистый этидий; в последнее время в обиход входят более безопасные вещества). Бромистый этидий светится оранжевым светом при облучении ультрафиолетом, причем при связывании с ДНК интенсивность свечения возрастает на несколько порядков (рис. 4). Другой метод заключается в использовании радиоактивных изотопов, которые необходимо предварительно включить в состав анализируемой ДНК. В этом случае на гель сверху кладут фотопластинку, которая засвечивается над полосами ДНК за счет радиоактивного излучения (этот метод визуализации называют авторадиографией).
Рисунок 4. Электрофорез в агарозном геле с использованием бромистого этидия для визуализации результатов в ультрафиолете (слева). Вторая слева дорожка — маркер с известными длинами фрагментов. Справа — Установка для проведения электрофореза в геле.
Кроме «обычного» электрофореза в пластине из геля, в некоторых случаях используют капиллярный электрофорез, который проводят в очень тонкой трубочке, наполненной гелем (обычно полиакриламидным). Разрешающая способность такого электрофореза значительно выше: с его помощью можно разделять молекулы ДНК, отличающиеся по длине всего на один нуклеотид. Об одном из важных приложений такого метода читайте ниже в описании метода секвенирования ДНК по Сэнгеру.
Видео:Введение в генную инженерию (видео 1) | Генная инженерия |Молекулярная генетикаСкачать

Выявление определенной последовательности ДНК в смеси. Саузерн блоттинг
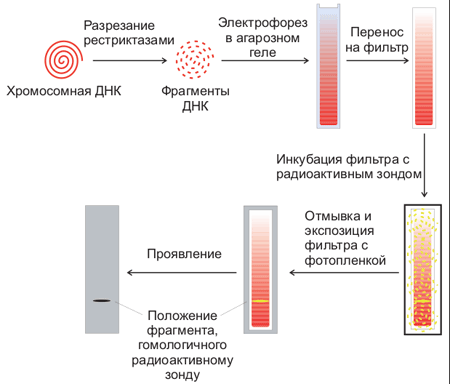
С помощью электрофореза можно узнать размер молекул ДНК в растворе, однако он ничего не скажет о последовательности нуклеотидов в них. С помощью гибридизации ДНК можно понять, какая из полос содержит фрагмент со строго определенной последовательностью. Гибридизация ДНК основана на образовании водородных связей между двумя цепями ДНК, приводящем к их соединению [3], [7].
Сначала необходимо синтезировать ДНК-зонд, комплементарный той последовательности, которую мы ищем. Он обычно представляет собой одноцепочечную молекулу ДНК длиной 10–1000 нуклеотидов. Из-за комплементарности зонд свяжется с необходимой последовательностью, а за счет флуоресцентной метки или радиоизотопов, встроенных в зонд, результаты можно увидеть.
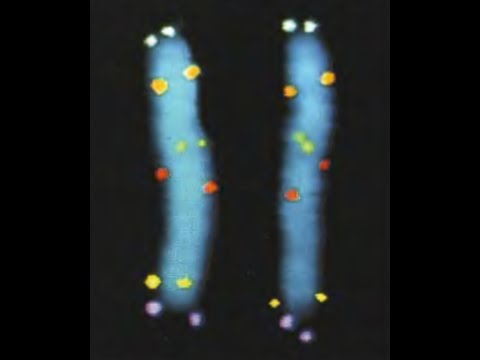
Для этого используют процедуру, называемую Саузерн-блоттинг или перенос по Саузерну, названную по имени ученого, ее изобретшего (Edwin Southern). Первоначально смесь фрагментов ДНК разделяют с помощью электрофореза. На гель сверху кладут лист нитроцеллюлозы или нейлона, и разделенные фрагменты ДНК переносятся на него за счет блоттинга: гель лежит на губке в ванночке с раствором щелочи, который просачивается через гель и нитроцеллюлозу за счет капиллярного эффекта от бумажных полотенец, сложенных сверху. Во время просачивания щелочь вызывает денатурацию ДНК, и на поверхность пластины нитроцеллюлозы переносятся и закрепляются там уже одноцепочечные фрагменты. Лист нитроцеллюлозы аккуратно снимают с геля и обрабатывают радиоактивно меченной ДНК-пробой, специфичной к необходимой последовательности ДНК. Лист нитроцеллюлозы тщательно отмывают, чтобы на нем остались только те молекулы пробы, которые гибридизовались с ДНК на нитроцеллюлозе. После авторадиографии ДНК, с которой гибридизовался зонд, будет видна как полосы на фотопластинке (рис. 5).
Рисунок 5. Схема проведения Саузерн-блоттинга.
Адаптация этой методики для определения специфических последовательностей РНК называется, в противоположность Саузерн-блоттингу, норзерн-блоттингом (northern blotting: southern по-английски означает «южный», а northern — «северный»). В этом случае проводят электрофорез в геле с молекулами мРНК, а в качестве зонда выбирают одноцепочечную молекулу ДНК или РНК.
Видео:Лидирующая и отстающая цепи при репликации ДНК (видео 8) | ДНК. Молекулярная генетика | БиологияСкачать
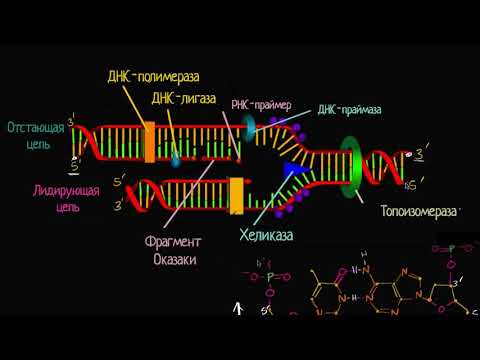
Клонирование ДНК
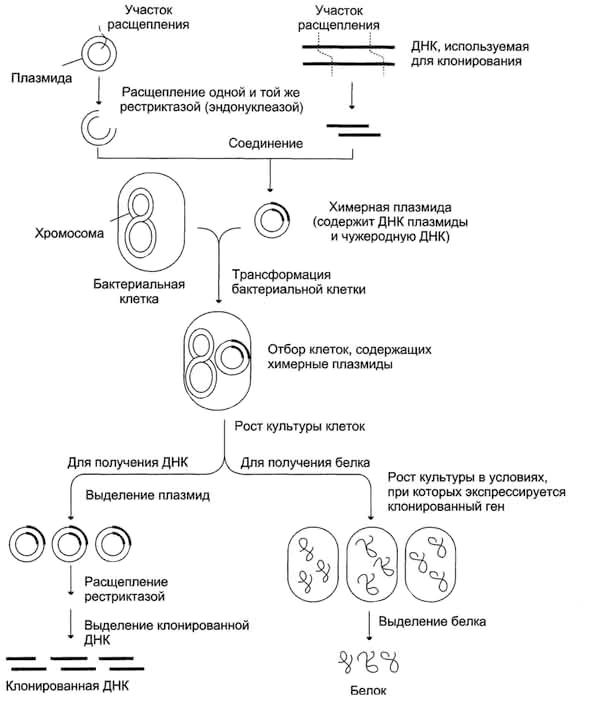
Мы уже знаем, каким образом можно разрезать геном на части (а их сшивать с произвольными молекулами ДНК), разделять полученные фрагменты по длине и с помощью гибридизации выбрать необходимый. Теперь настало время узнать, как, скомбинировав эти методы, мы можем клонировать участок генома (например, определенный ген). В геноме любой ген занимает крайне маленькую длину (по сравнению со всей ДНК клетки). Клонирование ДНК буквально означает создание большого числа копий определенного ее фрагмента. Именно за счет этой амплификации мы получаем возможность выделить участок ДНК и получить его в достаточном для изучения количестве.
Каким образом разделить фрагменты ДНК по длине и идентифицировать нужный — было рассказано выше. Теперь надо понять, каким образом можно копировать необходимый нам фрагмент. Существует два основных метода: использование быстро делящихся организмов (обычно бактерий Escherichia coli — кишечной палочки — или дрожжей Saccharomyces serevisiae) или проделать аналогичный процесс, но in vitro с помощью полимеразной цепной реакции.
Репликация в бактериях
Поскольку при каждом клеточном делении бактерии (как и любые другие клетки, не считая предшественников половых клеток) удваивают свою ДНК, это можно использовать для умножения количества необходимой нам ДНК [3]. Для того, чтобы внедрить наш фрагмент ДНК в бактерию, необходимо «вшить» его в специальный вектор, в качестве которого обычно используют бактериальную плазмиду (небольшую — относительно бактериальной хромосомы — кольцевую молекулу ДНК, реплицирующуюся отдельно от хромосомы). У бактерий «дикого типа» часто встречаются подобные структуры: они часто переносятся «горизонтально» между разными штаммами или даже видами бактерий. Чаще всего в них содержатся гены устойчивости к антибиотикам (именно из-за этого свойства их и открыли) или бактериофагам, а также гены, позволяющие клетке использовать более разнообразный субстрат. (Иногда же они «эгоистичны» и не несут никаких функций.) Именно такие плазмиды обычно и используют в молекулярно-генетических исследованиях. В плазмидах обязательно содержится точка начала репликации (последовательность, с которой начинается репликация молекулы), целевая последовательность рестриктазы и ген, позволяющий отобрать те клетки, которые обладают этой плазмидой (обычно, это гены устойчивости к какому-нибудь антибиотику). В некоторых случаях (например, при изучении очень больших фрагментов ДНК) используют не плазмиду, а искусственную бактериальную хромосому.
В плазмиду с помощью рестриктаз и лигаз встраивают необходимый фрагмент ДНК, после чего добавляют ее в культуру бактерий при специальных условиях, обеспечивающих трансформацию — процесс активного захвата бактерией ДНК из внешней среды (рис. 6). После этого проводят отбор бактерий, трансформация которых прошла успешно, добавляя соответствующий гену в плазмиде антибиотик: в живых остаются только клетки, несущие ген устойчивости (а, следовательно, и плазмиду). Далее, после роста культуры клеток, из нее выделяют плазмиды, а из них с помощью рестриктаз выделяют «наш» фрагмент ДНК (или использую плазмиду целиком). Если же ген вставили в плазмиду для того, чтобы получить его белковый продукт, необходимо обеспечить культуре условия для роста, а потом просто выделить требуемый белок.
Рисунок 6. Схема клонирования участка ДНК (гена) в бактериях.
На этом месте сразу же должен возникать вопрос: как же все это возможно было использовать до того, когда были расшифрованы геномы, да и чтение последовательности ДНК было еще дорогим и малораспространенным? Положим, с помощью рестрикции и клонирования полученных фрагментов мы получим библиотеку ДНК, то есть набор бактерий, несущих различные плазмиды, содержащие суммарно весь геном (или заметную его часть). Но каким образом мы сможем понять, в каком из фрагментов содержится необходимый ген? Для этого использовали метод гибридизации. Сначала необходимо было выделить белок нужного гена. После чего отсеквенировать его фрагмент, обратить генетический код и получить последовательность нуклеотидов (конечно, из-за вырожденности генетического кода приходилось пробовать много различных вариантов). В соответствии с ней химически синтезировали короткую молекулу ДНК, которую и использовали в качестве зонда для гибридизации.
Но в некоторых случаях этот метод давал сбои — например, так произошло с фактором свертывания крови VIII. Этот белок участвует в свертывании крови , и нарушения в его функциональности являются причиной одного из самых распространенных генетических заболеваний — гемофилии А. Раньше для лечения приходилось выделять этот белок из большого числа организмов, потому что не удавалось клонировать его для производства бактериями. Связано это было с тем, что его длина составляет около 180000 пар нуклеотидов, и он содержит много интронов (некодирующих фрагментов между кодирующими) — неудивительно, что ни в одну плазмиду этот ген не попал целиком.
Полимеразная цепная реакция (ПЦР)
Полимеразная цепная реакция — молекулярно-биологический метод, позволяющий добиться колоссального (до 10 12 раз) увеличения числа копий определенного фрагмента ДНК in vitro [3], [9]. Она была изобретена Кэри Муллисом (Kary Mullis) в 1983 году, за что в 1993 году он получил Нобелевскую премию по химии (совместно с М. Смитом). (См. также: «Кари Маллис, изобретатель ПЦР» [10].)
Метод основан на многократном избирательном копировании определенного участка ДНК при помощи ферментов в искусственных условиях. При этом происходит копирование только того участка ДНК, который удовлетворяет заданным условиям, и только в том случае, если он присутствует в исследуемом образце. В отличие от репликации ДНК в клетках живых организмов, с помощью ПЦР амплифицируют сравнительно короткие участки ДНК (обычно, не более 3000 пар нуклеотидов, однако есть методы позволяющие «поднимать» до 20 тысяч пар нуклеотидов — так называемый Long Range PCR).
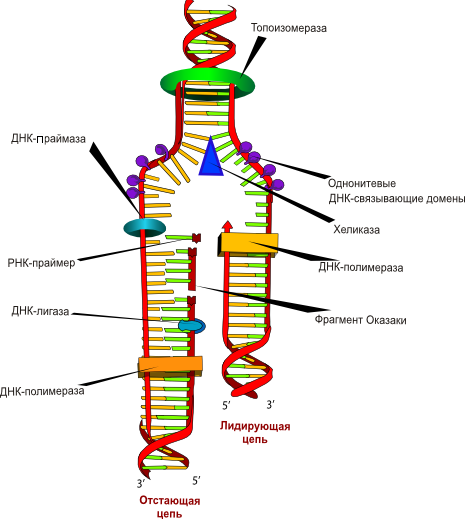
Фактически, ПЦР является искусственной многократной репликацией фрагмента ДНК (рис. 7). ДНК-полимеразы так устроены, что не могут синтезировать новую ДНК, просто имея в наличии матрицу и мономеры. Для этого необходима еще и затравка (праймер), с которого они начинают синтез. Праймер — это короткий одноцепочечный фрагмент нуклеиновой кислоты, комплементарный ДНК-матрице. При репликации в клетке такие праймеры синтезируются специальным ферментом праймазой и являются молекулами РНК, которые позже заменяются на ДНК. Однако в ПЦР используют искусственно синтезированные молекулы ДНК, поскольку в этом случае не нужна стадия удаления РНК и синтеза на их месте ДНК. В ПЦР праймеры ограничивают амплифицируемый участок с обеих сторон.
Рисунок 7. Репликация ДНК — важнейший для живых организмов процесс, основа множества молекулярно-биологических методов. Поскольку каждая из цепей ДНК содержит последовательность нуклеотидов, комплементарную другой цепи (их информационное содержание одинаково), при удвоении ДНК цепи расходятся, а затем каждая цепь служит матрицей, на которой выстраивается комплементарная ей новая цепь ДНК. В результате образуются два дуплекса ДНК, каждый из которых является точной (без учета ошибок синтеза) копией первоначальной молекулы.
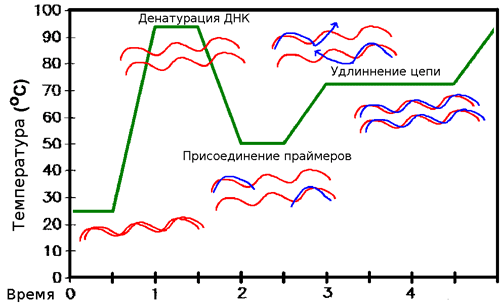
Итак, пора объяснить, как же ПЦР работает. Изначально в реакционной смеси находятся: ДНК-матрица, праймеры, ДНК-полимераза, свободные нуклеозиды (будущие «буквы» в новосинтезированной ДНК), а также некоторые другие вещества, улучшающие работу полимеразы (их добавляют в специальные буферы, используемые в реакции).
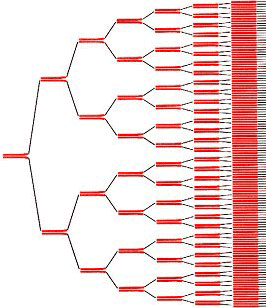
Чтобы синтезировать ДНК, комплементарную матрице, необходимо, чтобы один из праймеров образовал с ней водородные связи (как говорят, «отжегся» на ней). Но ведь матрица уже образует их со второй цепью! Значит, сначала необходимо расплавить ДНК, — то есть разрушить водородные связи. Делают это с помощью простого нагревания (до ≈95 °С) — стадия, называемая денатурацией. Но теперь и праймеры из-за высокой температуры не могут отжечься на матрице! Тогда температуру понижают (50–65 °С), праймеры отжигаются, после чего температуру немного поднимают (до оптимума работы полимеразы, обычно, около 72 °С). И тогда полимераза начинает синтезировать комплементарные матрице цепи ДНК — это называют элонгацией (рис . 8). После одного такого цикла количество копий необходимых фрагментов удвоилось. Однако ничто не мешает повторить это еще раз. И не один, а несколько десятков раз! И с каждым повтором количество копий нашего фрагмента ДНК будет удваиваться, ведь новосинтезированные молекулы тоже будут служить матрицами (рис. 9)! (На самом деле эффективность ПЦР редко настолько высока, что количество копий именно удваивается, но в идеале это так, да и реальные числа часто бывают близки к этому.)
Рисунок 8. Схема ПЦР.
Рисунок 9. С каждым циклом ПЦР количество целевой ДНК удваивается.
Увидеть результаты ПЦР очень просто: достаточно провести электрофорез реакционной смеси после ПЦР, и будет видна яркая полоса с полученными копиями.
Раньше полимеразу, инактивирующуюся при нагревании с каждым циклом, приходилось все время добавлять, но вскоре было предложено использовать термостабильную полимеразу из термофильных бактерий, которая выдерживает такой нагрев, что сильно упростило проведение ПЦР (чаще всего используют Taq-полимеразу из бактерии Thermus aquaticus [11]).
Чтобы избежать сильного испарения воды из реакционной смеси, в нее добавляют масло, покрывающее ее сверху, и/или используют нагревающуюся крышку термоциклера — прибора, в котором проводят ПЦР. Он быстро меняет температуру пробирок, и их не приходится постоянно перекладывать из одного термостата в другой. Для предотвращения неспецифического синтеза еще до нагрева и собственно начала циклов, часто использую ПЦР с «горячим стартом»: вся ДНК и полимераза разделяются между собой парафиновой прослойкой, которая плавится при высокой температуре и дает им взаимодействовать уже в правильных условиях. Иногда же используют модифицированные полимеразы, которые не работают при низкой температуре.
Можно еще много говорить о различных тонкостях ПЦР, но важнее всего сказать об альтернативных классическому форезу методах определения результатов. Например, довольно очевидным вариантом является добавление в реакционную пробирку перед началом реакции веществ, флуоресцирующих в присутствии ДНК. Тогда, сравнив изначальную флуоресценцию с конечной, можно увидеть, синтезировалось ли значительное количество ДНК или нет. Но этот способ не специфичен: мы никак не сможем определить, синтезировался ли необходимый фрагмент, или это какие-то праймеры слиплись и достроились до непредсказуемых последовательностей.
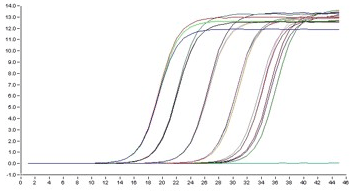
Наиболее интересным вариантом является ПЦР «в реальном времени» («real-time PCR») . Существует несколько реализаций этого метода, но идея везде одна и та же: можно прямо в ходе реакции наблюдать за накоплением продуктов ПЦР (по флуоресценции). Соответственно, для проведения ПЦР «в реальном времени» нужен специальный прибор, способный возбуждать и считывать флуоресценцию в каждой пробирке. Самое простое решение — добавить в пробирку те же самые вещества, которые флуоресцируют в присутствии ДНК, однако минусы такого метода уже были описаны выше.
Строго это называется «ПЦР с регистрацией флуоресценции в режиме реального времени» или «количественная ПЦР». — Ред.
Рисунок 10. Схема работы ПЦР «в реальном времени»: Taq Man Assay.
Рисунок 11. Пример кривых накопления флуоресценции в ПЦР «в реальном времени»: зависимость интенсивности флуоресценции (в нескольких пробирках — на каждую своя кривая) от номера цикла.
Самой популярной реализацией такого подхода является метод выщепления флуорофора за счет разрушения зонда (TaqMan Assay; рис. 10). В этом случае в реакционной смеси должен присутствовать еще один компонент — специальный одноцепочечный ДНК-зонд: молекула ДНК, комплементарная последовательности амплифицируемого фрагмента, расположенной между праймерами. При этом к одному его концу должен быть химически приделан флуорофор (флуоресцирующая молекула), а к другому — гаситель (молекула, поглощающая энергию флуорофора и «гасящая» флуоресценцию). Когда такой зонд находится в растворе или комплементарно связан с целевой последовательностью, флуорофор и гаситель находятся относительно недалеко друг от друга, и флуоресценции не наблюдается. Однако за счет 3´-экзонуклеазной активности, которой обладает Taq-полимераза (то есть она расщепляет ДНК, на которую «натыкается» в ходе синтеза, и на ее месте синтезирует новую), зонд при синтезе второй цепи разрушается, флуорофор и гаситель за счет диффузии удаляются друг от друга, и появляется флуоресценция.
Поскольку число копий в ходе ПЦР растет экспоненциально, так же растет и флуоресценция. Однако это продолжается недолго, поскольку в какой-то момент эффективность реакции начинает падать из-за постепенной инактивации полимеразы, нехватки каких-то компонентов и т. п. (рис. 11). Анализируя графики роста флуоресценции, можно много понять о протекании ПЦР, но, самое важное, можно узнать, сколько ДНК-матриц было изначально: это так называемая количественная ПЦР (quantitative PCR, qPCR).
Все варианты применения ПЦР в науке невозможно перечислить. Выделение фрагмента ДНК, секвенирование, мутагенез. ПЦР — один из самых востребованных для ненаучных целей метод (видео 1). Он широко применяется в медицине для ранней диагностики наследственных и инфекционных заболеваний, определения отцовства, в расследованиях для установления личности и для многого другого.
Видео 1. Восторг ученых по поводу изобретения ПЦР хорошо передает песня «Scientists for Better PCR» (хотя это и реклама фирмы BioRad, производящей, в том числе, оборудование и реагенты для ПЦР).
Видео:Вектор #2: Исследуем ДНК вместе с BiocadСкачать

Естественные клеточные процессы in vitro
Все основные молекулярно-биологические процессы могут быть легко проведены in vitro (то есть, в пробирке). Пример приведен выше: ПЦР — это аналог репликации ДНК. Для этого достаточно просто смешать необходимые реагенты в подходящих условиях: для транскрипции нужны ДНК-матрица, РНК-полимераза и рибонуклеотиды, для трансляции — мРНК, субъединицы рибосом и аминокислоты, для обратной транскрипции — РНК-матрица, обратная транскриптаза ( она же ревертаза) и дезоксирибонуклеотиды. Эти методы широко применяются в различных областях биологии, когда необходимо, например, получить чистую РНК определенного гена. В этом случае нужно сначала провести обратную транскрипцию его (гена) мРНК, с помощью ПЦР амплифицировать ее, а затем с помощью in vitro-транскрипции получить много мРНК. Первая стадия необходима из-за того, что перед образованием зрелой мРНК в клетке проходит сплайсинг и процессинг РНК (у эукариот; у бактерий в этом смысле все проще) — подготовка к работе матрицей для синтеза белка. Иногда этого удается избежать, если вся кодирующая последовательность гена расположена в одном экзоне.
Видео:Биохимия. Лекция 35. Матричные биосинтезы. Репликация ДНК.Скачать

Секвенирование ДНК
Можно сказать, важнейшие методы манипуляции с ДНК уже описаны. Следующий этап — определение собственно нуклеотидной последовательности цепи в молекуле — секвенирование. Определение нуклеотидной последовательности ДНК крайне важно для множества фундаментальных и прикладных задач. Особое место оно занимает в науке: для анализа результатов секвенирования геномов была, фактически, создана новая наука — биоинформатика. Секвенированием сейчас пользуются молекулярные биологи, генетики, биохимики, микробиологи, ботаники и зоологи, и, конечно же, эволюционисты: практически вся современная систематика основана на его результатах. Секвенирование широко применяется в медицине как метод поиска наследственных заболеваний и изучения инфекций. (См., например, «Уточнение „родословной“ членистоногих» и « Ск верный анекдот: негр, китаец и Крейг Вентер. ». — Ред.)
На самом деле хронологически методы изобретались совсем в другом порядке. Например, секвенирование по Сэнгеру было разработано в 1977 году, а ПЦР, как говорилось выше, только в 1983-м.
Существует множество различных методик секвенирования, но все методы можно разделить на две категории: «классические» и нового поколения. Сейчас используется фактически только один «классический» метод — секвенирование по Сэнгеру , или метод терминаторов. По сравнению с новыми методами, у него есть важное преимущество: длина прочтения, то есть количество нуклеотидов в последовательности, которое можно получить за один раз, у него выше — до 1000 нуклеотидов [12]. В то же время у самого «хорошего» в этом плане «нового» метода секвенирования — 454-, или пиросеквенирования [13] — этот параметр не превышает 500 нуклеотидов . Именно длина прочтения ограничивает возможности новых методов: оказывается крайне сложно «собрать» целый геном из фрагментов размером в несколько десятков нуклеотидов. Как минимум, для этого требуются суперкомпьютеры, а некоторые места в геноме разрешить оказывается просто невозможно, если они содержат высокоповторяющиеся последовательности. В таком случае может помочь сравнение полученных фрагментов с уже имеющимся целым геномом, но таким образом невозможно прочесть геном организма впервые (de novo). (См. также: «Код жизни: прочесть не значит понять». — Ред.)
Английский биохимик и корифей молекулярной биологии, дважды лауреат Нобелевской премии по химии: за определение аминокислотной последовательности инсулина (1955 г.) и за разработку метода секвенирования ДНК (1980 г.). — Ред.
Есть метод нового поколения, позволяющий читать несколько тысяч пн, но с большими ошибками (Pacific Biosciences). 454/Roche сегодня могут читать и больше 500 пн; то же самое уже может и молодое «полупроводниковое секвенирование». — Ред.
Оба упомянутых выше метода секвенирования уже достаточно подробно описаны на «биомолекуле» [13]: очень советую ознакомиться. Я же для примера расскажу про другой распространенный быстрый и дешевый метод (в расчете на один прочитанный нуклеотид) — метод, реализованный в секвенаторах Illumina (видео 2). Основной его недостаток — чтение фрагментов очень короткой длины, не больше 100 нуклеотидов, и вытекающая отсюда сложность прочтения геном «с нуля» [14].
В этом методе можно выделить три стадии: подготовку библиотеки фрагментов (1), создание кластеров (2) и собственно секвенирование (3).
Видео 2. В интернете есть несколько хороших видео, на которых описан процесс секвенирования Illumina, например на официальном сайте компании (вкладка Technology). Правда, они все на английском языке.
- Сначала создается библиотека фрагментов ДНК из секвенируемого генома (или любого другого источника ДНК). ДНК с помощью ультразвука или специального фермента расщепляется на произвольные фрагменты длиной в несколько сотен нуклеотидов, из которых выбираются обладающие заданной длиной (выбирается экспериментатором). После этого к ним с двух концов ковалентно присоединяются различные адаптерные последовательности (рис. 12: 1);
Рисунок 12. Подготовка к секвенированию Illumina.
Рисунок 13. Собственно секвенирование Illumina.
Было уже довольно много сказано про методы работы с нуклеиновыми кислотами и их изучения. Пришло время узнать, каким образом можно выяснить, как же клетка работает — в частности, попытаться определить функцию гена и белка, который он кодирует.
Видео:Структура и функции ДНК — курс Максима Франк-Каменецкого на ПостНаукеСкачать

In vitro-мутагенез
Для изучения функции белка очень важно научиться вносить в него мутации. Например, имея организм с неработающим ферментом, можно по биохимическим отличиям понять, что делает нормальный белок. Существуют разные способы создать полностью неработающий ген (как произвольный из всего генома, так и совершенно конкретный — тогда это называется нокаутом этого гена). Один из таких способов — вставка какого-то фрагмента ДНК в геном: если эта вставка придется на ген, то он (точнее, скорее всего, белок, который он кодирует) перестанет нормально функционировать.
Однако существуют способы очень точного изменения последовательности гена и, соответственно, белка. Про один из таких методов — сайт-специфичный мутагенез — я и расскажу. Суть его заключается в изменении конкретного (обычно одного) нуклеотида в последовательности. Для его использования сначала необходимо клонировать этот ген в плазмиде. После этого нужно провести как бы ПЦР с одним праймером. Причем этот праймер должен как раз включать в себя последовательность, которую мы хотим изменить — уже в нужном нам виде. Например, на рис. 14 вместо буквы А, которая должна была бы стоять напротив Т в родительской цепи, в праймере стоит Ц. После синтеза второй цепи ДНК плазмиды, содержащей праймер, в нее будет внесена мутация — А заменится на Ц. Такие плазмиды вводятся в клетки, в которых при делении две цепи окажутся в разных дочерних клетках. Таким образом, в половине клеток-потомков будет изначальный вариант плазмиды, а в половине — мутантный. Тогда, соответственно, половина клеток будет производить нормальный белок, кодируемый этим геном, а половина — мутантный. В случае, изображенном на рис. 14, в нем вместо одной аминокислоты (аспарагина) будет стоять другая (аланин). По аналогии можно вносить случайные мутации с помощью специальной ДНК-полимеразы, вносящей повышенное число ошибок.
Рисунок 14. Схема проведения сайт-специфичного мутагенеза.
Bruce Alberts et al. Molecular biology of the cell. 5 th edition.
Видео:Рекомбинантная дезоксирибонуклеиновая кислота. Способы получения. 11 класс.Скачать

Системная РНК-интерференция
РНК-интерференция — недавно (менее 20 лет назад) открытый феномен подавления экспрессии генов в присутствии определенных коротких фрагментов РНК. За открытие и изучение этого явления Эндрю Файер (Andrew Fire) и Крейг Мелло (Craig Mello) получили Нобелевскую премию по физиологии и медицине в 2006 году. Биомолекула уже достаточно писала про РНК-интерференцию: «Обо всех РНК на свете, больших и малых» [15], я же расскажу о так называемой системной РНК-интерференции у «модельной» нематоды C. elegans, — то есть, об отключении гена во всех (почти) клетках этого червя.
Такой поразительный эффект достигается с помощью введения в клетку двуцепочечных молекул РНК (дцРНК), одна из цепей в каждой из которых комплементарна участку мРНК «выключаемого» гена. Это открывает поразительные возможности для изучения функций генов. Раньше для отключения генов приходилось создавать «нокаутных» животных (что ученые все равно вынуждены делать, например, с мышами — см. «Нобелевскую премию по физиологии и медицине вручили за технологию нокаутирования мышей». — Ред.), у которых изучаемый ген в принципе отсутствует в геноме. Однако создание нокаутов достаточно сложно, а обратно включить ген у таких организмов уже невозможно. С помощью РНК-интерференции отключить ген очень легко, — так же, как и включить, перестав водить в организм соответствующие дцРНК [16].
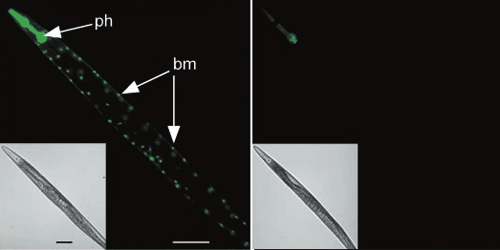
Существует три основных способа введения дцРНК в организм. Самый очевидный — впрыскивание в животное их раствора. Пользуются также «вымачиванием» нематод в растворе РНК. Однако оказалось, что можно делать все гораздо проще: скармливать нематодам эти молекулы! Причем особенно удобно то, что это так же замечательно работает, если нематод кормить бактериями (E. coli), синтезирующими эти дцРНК (рис. 15) [17].
Рисунок 15. Системная РНК-интерференция. Червь C. elegans экспрессирует зеленый флуоресцентный (светящийся) белок в клетках глотки (ph) и мышцах стенки тела (bm). Слева — изначальный внешний вид. Справа — при РНК-интерференции с помощью «подкормки» бактериями ген инактивируется.
В принципе то, что молекулы РНК из кишечника распространяются практически по всем тканям, довольно удивительно. Известно, что за попадание молекул РНК в клетки кишечника отвечает белковый канал sid-1 [18], [19]. Однако каким образом РНК распространяются по организму червя, достоверно не известно, — скорее всего, с участием белка rsd-8 [16] Интересно, что все известные белки, принимающие участие в системной РНК-интерференции у C. elegans, имеются и у человека, однако такую эффективную систему искусственного подавления активности генов на системном уровне у человека наблюдать не удается. Если бы была возможность использовать системную РНК-интерференцию у человека, это могло бы стать методом борьбы с огромным набором заболеваний, от простуды до рака .
К слову, использование РНК-интерференции именно на культуре клеток человека позволило выявить, что многие гены человека способствуют развитию вируса гриппа: «Молекулярное двурушничество: гены человека работают на вирус гриппа». — Ред.
Видео:«ДНК, РНК, белки, генетический код и рибосома». Спикер: Андреев Дмитрий ЕвгеньевичСкачать

Изучение экспрессии генов: ДНК-микрочипы
При изучении функции гена очень важно узнать, когда и в каких тканях организма он работает (экспрессируется), а также вместе с какими другими генами. Если требуется узнать это про небольшое число генов и тканей, то можно это сделать очень просто: выделить РНК из ткани, провести обратную транскрипцию (то есть, синтезировать кДНК — комплементарную ДНК) и затем, провести количественную ПЦР. В зависимости от того, прошла ли ПЦР, мы узнаем, имеется ли мРНК исследуемого гена в ткани.
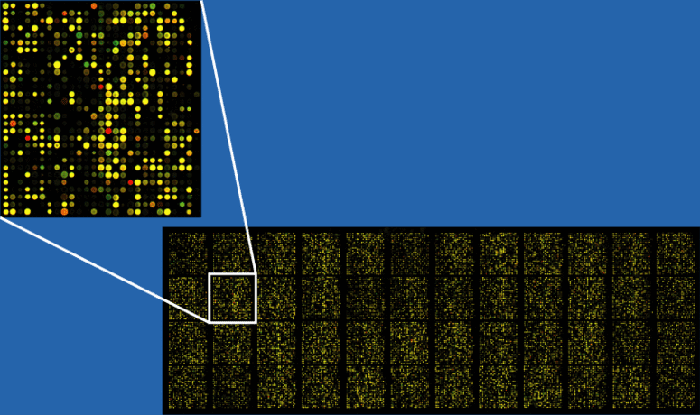
Однако если необходимо проделать то же самое для множества тканей и многих генов, то эта методика становится очень долгой и затратной. В таком случае используют ДНК-микрочипы [3]. Это небольшие пластинки, на которые нанесены и прикреплены молекулы ДНК, комплементарные РНК изучаемых генов, причем заранее известно, где на них (пластинках) какая молекула расположена. Одним из способов создания чипа является синтез молекул ДНК прямо на нем с помощью робота.
Чтобы изучать экспрессию генов с помощью чипов, необходимо также синтезировать их кДНК и пометить ее флуоресцентным красителем (не разделяя кДНК разных генов). Такую смесь наносят на микрочип, добиваясь, чтобы кДНК гибридизовалась с молекулами ДНК на чипе. После этого смотрят, где наблюдается флуоресценция и сравнивают это с расположением молекул ДНК на чипе. Если место флуоресценции совпадает с положением молекулы ДНК, то в данной ткани этот ген экспрессирован. Кроме того, пометив кДНК из разных тканей разными красителями, можно изучать экспрессию сразу нескольких (обычно все-таки не больше 2) тканей на одном чипе: по цвету флуоресценции можно определить, в какой из тканей он экспрессирован (если сразу в нескольких — получится смешанный цвет) (рис. 16).
Рисунок 16. Флуоресценция на ДНК-микрочипе после обработки раствором кДНК. Всего тут примерно 37500 прикрепленных молекул ДНК.
Однако в последнее время все чаще вместо чипов используют массовое секвенирование всей кДНК из ткани (создание так называемых транскриптомов), что сильно упростилось из-за развития методов секвенирования. Это оказывается дешевле и эффективнее, поскольку знание полных последовательностей всех мРНК дает больше информации, чем просто сам факт их наличия или отсутствия.
Мы рассмотрели основные методы молекулярной биологии. Надеюсь, что вам стало немного понятнее, каким образом делаются молекулярно-биологические исследования, за что дают Нобелевские премии, и как они могут помочь в некоторых прикладных задачах. Но, более всего, я надеюсь, что вы тоже увидели красоту идей, лежащих в их основе, и, возможно, вам захотелось узнать о каких-то из этих методик подробнее.
Видео:Полимеразная цепная реакция (ПЦР), амплификация ДНК, рестрикция, рекомбинантные плазмиды для ЕГЭСкачать

Лигирование днк с вектором
Одна из основных целей современной медицинской генетики — охарактеризовать мутации, ведущие к генетической болезни, понять, как они влияют на здоровье, и использовать эту информацию для улучшения диагностики и лечения.
Прогресс в понимании молекулярной генетики связан с появлением технологий детального анализа нормальных и патологических генов, а также экспрессии тысяч генов в нормальном и патологическом состояниях. Благодаря этим методам стало возможным более глубокое понимание молекулярных процессов на всех уровнях, от гена до целого организма.
Молекулярные генетики сталкиваются с двумя фундаментальными препятствиями в исследованиях молекулярной основы наследственных болезней.
Первое препятствие — необходимость получения для анализа достаточных количеств интересующей последовательности ДНК или РНК. Каждая клетка обычно имеет только две копии гена, а некоторые гены могут транскрибироваться только в немногих тканях или только в малых количествах, формируя небольшое количество молекул мРНК.
Второе препятствие — необходимость отделения интересующей последовательности от других сегментов ДНК или молекул мРНК, присутствующих в клетке. Молекулярное клонирование и полимеразная цепная реакция (ПЦР) —технологические революции, решившие проблему получения ДНК или РНК для подробного анализа в достаточном количестве и нужной чистоты. Вместе с технологическими возможностями появился и собственный жаргон.
Молекулярное клонирование
Цель молекулярного клонирования — выделить для последующего анализа конкретный ген или другую ДНК-последовательность в больших количествах. При молекулярном клонировании интересующую последовательность ДНК вводят в клетку микроорганизма. Затем микроорганизм выращивают в культуре, где он воспроизводит вместе со своей собственной ДНК исследуемую ДНК-последовательность.
Поскольку каждый индивидуальный микроорганизм в колонии происходит от единственной исходной клетки и содержит тот же сегмент ДНК, он называется клоном, а весь процесс получения больших количеств интересующей последовательности ДНК назван молекулярным клонированием. Затем большие количества интересующей последовательности выделяют из клона в чистой форме для подробного молекулярного анализа.
Видео:Репликация ДНК. Секрет бессмертия. БиохимияСкачать
Видео генетика клонирования ДНК
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
— Вернуться в содержание раздела «генетика» на нашем сайте
💥 Видео
GI3. Как решать задачи на клонирование: расчет смеси для лигированияСкачать

Свойства плазмид и их использование в генетическом клонировании. 11 класс.Скачать

МОЛЕКУЛЯРНАЯ БИОЛОГИЯ (создание белка)Скачать

Анализ и манипуляции с ДНКСкачать