- II Встраивание гена в генетический элемент, способный к репликации (вектор).
- Молекулярное клонирование, или как засунуть в клетку чужеродный генетический материал
- Молекулярное клонирование, или как засунуть в клетку чужеродный генетический материал
- «Био/мол/текст»-2011
- Вставка
- Вектор
- Плазмида
- Размножение
- Разрезание
- Селекция
- Промоторы
- Трансляция белка
- Плазмидные базы данных
- Другие векторы
- Вставляем ген в плазмиду
- Выделяем вектор
- Как засунуть вектор в клетки
- Вещества-проводники
- Дырки в мембране
- Овечки в волчьей шкуре
- Ретро
- Ленти
- Адено
- Последний шаг
- Генная инженерия бактерий: как внести нужные нам гены в составе плазмидного вектора в бактерию
- 1) Строение клеточной оболочки бактерий
- 2) Механизмы индуцированного транспорта соединений в клетки из внешней среды
- 2.1) Облегчённая диффузия
- 2.2) Активный транспорт
- 3) Компетентность бактериальных клеток
- 3.1) Естественная компетентность бактериальных клеток
- 3.2) Искусственная компетентность бактериальных клеток
- 3.2.1) Обработка клеточной культуры двухвалентными ионами с последующим кратковременным нагреванием.
- 3.2.2) Электропорация
- Послесловие
- Молекулярные векторы, используемые в генетической инженерии
- Общие представления о нуклеиновых кислотах
- Функции и главнейшие типы векторов
- Назначение векторов:
- Главнейшие типы векторов (по назначению):
- Молекулярный вектор должен обладать:
- Необходимые свойства клонирующих векторов:
- Молекулярное клонирование, или как засунуть в клетку чужеродный генетический материал
- Молекулярное клонирование, или как засунуть в клетку чужеродный генетический материал
- «Био/мол/текст»-2011
- Вставка
- Вектор
- Плазмида
- Размножение
- Разрезание
- Селекция
- Промоторы
- Трансляция белка
- Плазмидные базы данных
- Другие векторы
- Вставляем ген в плазмиду
- Выделяем вектор
- Как засунуть вектор в клетки
- Вещества-проводники
- Дырки в мембране
- Овечки в волчьей шкуре
- Ретро
- Ленти
- Адено
- Последний шаг
Видео:Зачем нужен ВЕКТОР. Объяснение смыслаСкачать

II Встраивание гена в генетический элемент, способный к репликации (вектор).
КОНСТРУИРОВАНИЕ ПРОДУЦЕНТОВ С ПОМОЩЬЮ ГЕННОЙ ИНЖЕНЕРИИ. ГЕНЕТИЧЕСКАЯ ИНЖЕНЕРИЯ РАСТЕНИЙ.
1. Сущность и задачи генной инженерии.
Для того, чтобы искусственным путем наделить какой-либо организм новыми наследственными свойствами, нужно ввести в него хотя бы один чужеродный ген, причем, необходимо приготовить (сконструировать) фрагмент чужеродной ДНК, содержащий этот нужный ген.
Генная инженерия, или техника рекомбинантных ДНК, — это совокупность приемов, позволяющих in vitro перенести генетический материал из одного организма(источника генов) в другой (реципиент) так, чтобы обеспечить наследование этих генов в новом для них организме.
Одной из главных задач генной инженерии является получение организмов с желаемыми свойствами. Одним из последних сверх достижений генной инженерии является создание искусственной клетки, о чем доложил 2010 году Крейг Вентер.
Методами генной инженерии возможно преодолевать межвидовые барьеры, то есть переносить гены и передавать отдельные наследственные признаки одних организмов другим (напр., от человека или животного — бактериям, растениям и др.). Получают генетически модифицированные микроорганизмы (трансгенные или рекомбинантные) обладающие сверхпродукцией для производства инсулина, соматотропина, интерферона и многих других белков.
2. Этапы получения генетически модифицированных микроорганизмов–продуцентов:
Iвыделение нужного (целевого) гена;
II встраивание гена в генетический элемент, способный к репликации (вектор);
III введение вектора в организм-реципиент;
VI идентификация (скрининг) и отбор клеток, которые приобрели желаемый ген или гены.
I Выделение нужного (целевого) гена. Выделение генов – один из главных этапов в генетической инженерии. Существует два основных способа получения гена: синтез и выделение из ДНК.
Синтез гена осуществляется 2-мя путями
А. Химико-ферментативный синтез генов (применяется наиболее часто).
Химическим путем синтезируют олигонуклеотиды или праймеры (короткие одноцепочечные фрагменты ДНК — 8-16 нуклеотидов), а гены синтезируют ферментативным методом с помощью ПЦР. Химический синтез генов возможен когда известен нуклеотидный состав (первичная структура) гена или первичная структура кодируемого геном полипептида.
Б. Синтез генов с помощью обратной транскрипциинамРНК. Выделяют мРНК соответствующего гена из полирибосом и используют ее в качестве матрицы для фермента ревертазы. Метод основан на универсальной способности обратных транскриптаз синтезировать двунитевую ДНК на однонитевых РНК-матрицах.
Гены также могут быть получены из уже созданных геномных библиотек, которые представляют собой совокупность фрагментов геномной ДНК какого-либо организма или из библиотек кДНК.
2)Выделение гена из ДНКклетки с нужными свойствами.Необходимо точно знать расположение гена и вырезать его при помощи рестриктаз. Каждая из рестриктаз узнает свой сайт рестрикции и разрезает ДНК либо внутри сайта, либо в непосредственной близости от него.Рестриктазы (своеобразные молекулярные ножницы), действуя на двухцепочечную ДНК, «узнают» в ней определенную последовательность нуклеотидов. Причем, каждая рестриктаза узнает только свою последовательность ДНК, прикрепляется к ней и разрезает ее в месте прикрепления. Рестриктазам безразлично, какую ДНК разрезать – человека или растения, бактерии или вируса, лишь бы в ней были распознаваемые участки.
Это значит, что две совершенно несхожих между собой последовательности ДНК (допустим из клеток слона и лягушки) при обработке одной и той же рестриктазой легко можно сшить (слепить) друг с другом.
II Встраивание гена в генетический элемент, способный к репликации (вектор).
Выделенный или синтезированный ген не может самостоятельно встраиваться в ДНК клетки-мишени и тем более начинать функционировать. Для переноса целевого гена создают специальную конструкцию — вектор, несущий полученный ген и способный встраиваться в геном клетки. Генетический вектор – это молекула ДНК или РНК, которые способны переносить в клетку чужеродную ДНК, обеспечить еѐ амплификацию и интеграцию в геном.
1.Требования к генетическим векторам:
— вектор должен быть небольшим и содержать сайты рестрикции для нескольких рестриктаз, должен обладать определенной емкостью;
— вектор должен иметь точку начала репликации (ori), т.е. автономно реплицироваться, накапливаться в многочисленных копиях в клетке хозяина и сохраняться в дочерних клетках при делении материнской;
— иметь функциональный генпромотор (прокариотический или эукариотический), способный экспрессироваться в клетке;
— должен иметь маркерный ген, позволяющий различать гибридные клетки для эффективной селекции;
— должен быть способным передаваться в клетку соответствующего организма.
2. Характеристика векторов для переноса генетической информации в прокариотические клетки.
В качестве прокариотических векторов чаще используют плазмидыбактерий, бактериофаги.
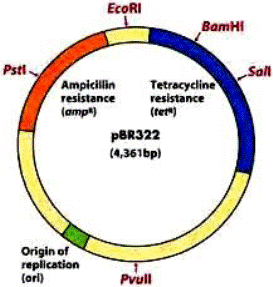
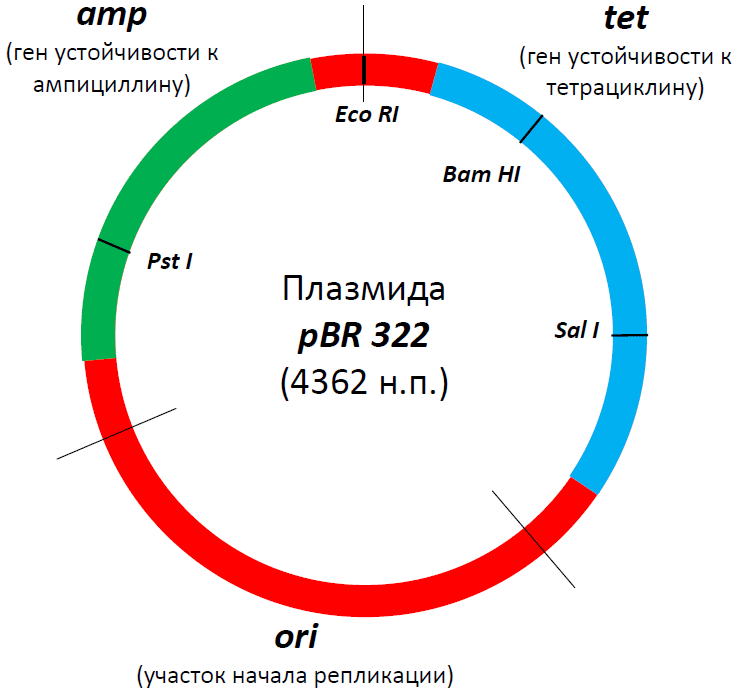
Плазмидыбактерий способны реплицироваться независимо от хромосомы это их главное свойство.Плазмиды могут быть выделены из клетки и использованы в неповрежденном, нативном состоянии. В векторной плазмиде E.colipBR322есть маркерные гены устойчивости к ампициллину и к тетрациклину. Бактериальные клетки, содержащие такой вектор, устойчивы одновременно к ампициллину и тетрациклину. Плазмидные векторы удобны для клонирования небольших фрагментов (до 10 тыс. пар оснований) геномов, т.е. плазмидные векторы обладают небольшой емкостью.
Бактериофаги – вирусы бактерийспособны встраиваться в геном клетки хозяина (вызывать лизогенизацию).
Бактериофаги широко распространены в природе — их выделяют из воды, почвы, организмов различных животных и человека. Большинство фагов ДНК-содержащие вирусы, имеют смешанный тип симметрии капсида. Широко используют векторы на основе бактериофагов E.coli —λ и М13. Из ДНК фага удаляют области, не существенные для репликации в клетках E.coli, и оставляют сайты, предназначенные для встраивания фага в геном клетки хозяина (фаговый вектор должен проникнуть в клетку и встроиться в геном). В эту же область встраивают целевой и маркерные гены. На основе бактериофага λ можно сконструировать векторы емкостью до 25 т.п.н.
3. Характеристика векторов для переноса генетической информации в эукариотические клетки.
В качестве эукариотических векторов используют вирусы животных и растений,Tiплазмиды агробактерий (Agrobakterium tumefaciens), а также искусственно сконструированные векторы, способные реплицироваться как в бактериальных, так и в эукариотических клетках (челночные векторы).
Длина плазмиды 4361 п.н., она имеет 2 гена устойчиво-сти к антибиотикам: ампициллину (Ampr), тетрациклину (Tetr), а также сайты для рестриктаз: — BamHI (Bacillus amyloliquefaciens H) — HindIII (Haemophilus influenzae d) — SalImonella (Streptomyces albus) — PstI (Providencia stuartii) — EcoRI (E.Coli) (Escherichia coli).
4.Создание генетической конструкции.
Очищенную кольцевую плазмиду E.coli pBR322 обрабатывают ферментом рестриктазой BamH1, которая специфически разрезает плазмиду в единственном сайте, расположенном в гене устойчивости к тетрациклину, так что образуется линейная молекула с липкими концами. Такие молекулы смешивают с подготовленным участком ДНК (с нужным геном), содержащим комплементарные липкие концы.
Поскольку липкие концы этих двух ДНК взаимно комплементарны, они спариваются с образованием гибридных молекул. Далее смесь обрабатывают ДНК-лигазой для сшивания комплементарных концов нужного гена и вектора.
При включении фрагментов ДНК в участок гена резистентности к тетрациклину, устойчивость к тетрациклину из-за этой вставки нарушается, и все рекомбинантные плазмидысохраняют устойчивость только к ампициллину. Таким образом, высевая клетки на среды с антибиотиками, можно отобрать клоны, содержащие рекомбинантные молекулы ДНК.
Гибридные векторы, содержащие ДНК фага и плазмиды- космиды и фазмиды.
Космиды – плазмидные векторы, в которые встроен участок генома фага λ, обеспечивающий возможность упаковки этой молекулы ДНК в фаговую частицу. Фаговые частицы обеспечивают хорошее проникновение гибридной ДНК в клетку (путем инъекции), после чего происходит замыкание ДНК в кольцо по липким концам и репликация ее по плазмидному типу.
Фазмиды также являются гибридами между фагом и плазмидой. После встройки чужеродной ДНК могут в одних условиях развиваться как фаги, в других – как плазмиды.
Векторы на основе РНК-содержащих вирусов или ретровирусов (Retroviridae). Они легко интегрируют в геном клетки-хозяина, тем самым обеспечивая долговременную экспрессию необходимого гена. Попадая внутрь клетки, ретровирусная РНК превращается в ДНК путем хорошо теперь известного процесса обратной транскрипции. Эта ДНК встраивается в геномную ДНК и с этого момента становится неотъемлемой частью генома клетки (является провирусом). Инфицирование организма ретровирусами – это своего рода естественно-природный механизм генетической модификации клетки. Наиболее часто в качестве вектора применяют вирус лейкемии мышей.
Векторы на основе ДНК-геномных вирусов. Векторы, созданные на основе ДНК-вирусов обладают большими размерами по сравнению с РНК-геномными вирусами и поэтому могут вмещать фрагменты ДНК (трансгены) длиной до 35 000 пар оснований. С точки зрения переноса чужеродного ДНК в организм реципиента удобными оказались так называемые «челночные векторы», способные реплицироваться как в клетках животных, так и в клетках бактерий. Их получают, сшивая друг с другом большие сегменты вирусов животных и бактерий (например, SV40 и pBR322) так, чтобы области, ответственные за репликацию ДНК, остались незатронутыми. Это позволяет проводить основные операции по конструированию вектора в бактериальной клетке, а затем полученную рекомбинантную ДНК использовать для клонирования генов в животной клетке.
Видео:Введение в генную инженерию (видео 1) | Генная инженерия |Молекулярная генетикаСкачать

Молекулярное клонирование, или как засунуть в клетку чужеродный генетический материал
30 октября 2011
Видео:19 20 Базовые методы генной инженерииСкачать
Молекулярное клонирование, или как засунуть в клетку чужеродный генетический материал
- 27924
- 14,4
- 13
- 23
Клонирование овечек имеет лишь самое опосредованное отношение к молекулярному клонированию. На фоне овечки Долли показана плазмида phMYT1L-N106.
коллаж автора статьи
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Огромное количество биологических исследований начинается с того, что в клетку вносится чужеродный генетический материал. Это действие называется молекулярным клонированием. С его помощью можно получить генетически модифицированные организмы, включить и выключить отдельные гены или определить роль конкретного белка в каком-нибудь процессе. Можно сказать, что молекулярное клонирование — это краеугольный камень, основа основ, фундамент, без которого множество замечательных методик было бы неосуществимо. Однако засунуть в клетку «неродную» ДНК не так-то просто: это длинный, трудоемкий и многоэтапный процесс. Молекулярному клонированию посвящены толстые книги, но, тем не менее, я попробую хотя бы немного рассказать о том, что это такое, и что нужно для того, чтобы все получилось.
Видео:Генная инженерия за 4 минутыСкачать

«Био/мол/текст»-2011
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2011 в номинации «Лучшая обзорная статья».
Видео:Клонирование ДНК и рекомбинантная ДНК (видео 4) | Генная инженерия | Молекулярная генетикаСкачать

Вставка
Раз мы собираемся вставлять в клетки какой-то ген, то самый первый, очевидный шаг, который нам нужно сделать, — этот ген как-нибудь получить, причем желательно в больших количествах (поскольку все методики несовершенны, бóльшая часть копий этого гена бесследно пропадет по дороге нецелевым способом). Чужеродный ген, вносимый в клетку, называется «геном-вставкой» или просто «вставкой». Получить его можно несколькими способами.
Во-первых, мы можем просто выделить его из того генома, к которому он принадлежит. Допустим для простоты, что наша вставка — это какой-нибудь ген слона. Тогда нам нужно:
- получить образец тканей слона;
- извлечь из этого образца ДНК;
- вычленить из этой ДНК интересующий нас ген и получить его в больших количествах (для этого используется ПЦР ). [Заметим в скобках, что получение гена с помощью ПЦР возможно, только если мы знаем его нуклеотидную последовательность или хотя бы последовательность его начала и окончания (для того, чтобы можно было синтезировать праймеры). Если же все это нам неизвестно, то придется сначала анализировать слоновий геном.]
Подробнее с методом ПЦР и другими основными молекулярно-биологическими методиками можно ознакомиться в статье «Важнейшие методы молекулярной биологии и генной инженерии»; с геномными исследованиями — в статье «Геном человека: как это было и как это будет». — Ред.
Во-вторых, вполне возможно, что нужный нам ген уже был выделен из генома слона и присутствует в библиотеке генов. Тогда нашу вставку можно будет получить оттуда (с этим, на самом деле, тоже придется повозиться, но меньше, чем в первом случае).
И наконец, в-третьих, не обязательно использовать в качестве вставки уже существующий ген. Если исследователь собирается работать с каким-нибудь геном, который является плодом его фантазии и не встречается в природе, то он может синтезировать его искусственно.
Видео:Возможности генной инженерии | Лекции по биологии – биолог Александр Панчин | НаучпопСкачать

Вектор
Запускание в клетку «одинокой» вставки (то есть, гена самого по себе, безо всякого сопровождения) — дело совершенно бесперспективное. В клетке плавает множество расщепляющих ДНК ферментов (нуклеаз), которые с радостью набросятся на беззащитную вставку и разрежут ее на кусочки, в результате чего она бесславно исчезнет, не успев совершить ничего полезного, а клонирование провалится.
Поэтому, чтобы защитить вставку, ее встраивают в специальное «транспортное средство», которое называется вектором. В самом элементарном случае вектор — это просто последовательность ДНК, в которую вшивается наша вставка, и которая помогает ей не пропасть в клетке и выполнить свое предназначение. Существует несколько видов векторов, но среди исследователей самой большой (и заслуженной) любовью пользуется один из них — плазмиды. С них-то мы и начнем.
Видео:Генная инженерияСкачать

Плазмида
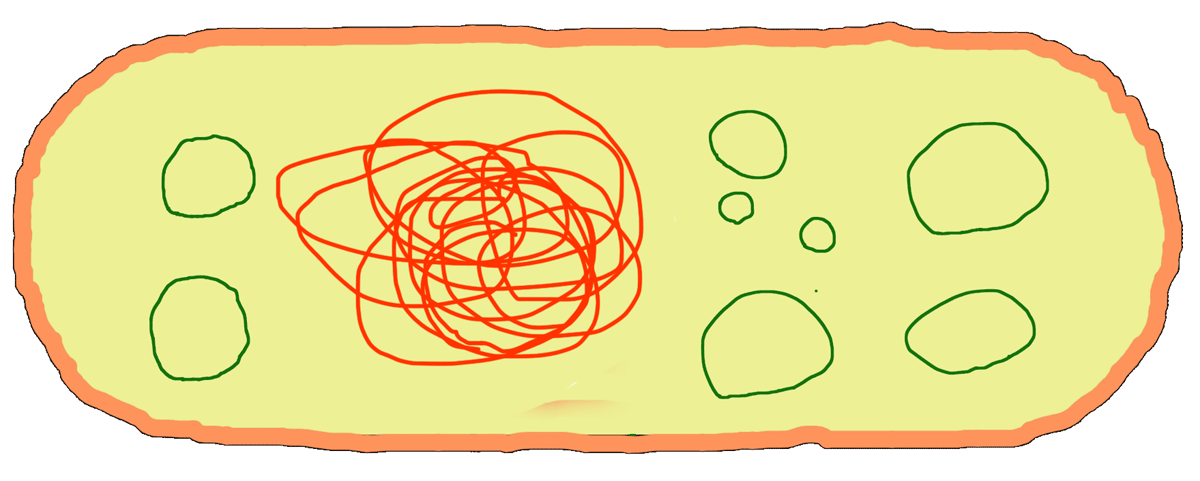
Плазмида — это довольно короткая и обычно кольцевая молекула ДНК, которая плавает в цитоплазме бактериальной клетки (зеленые кружочки на рис. 1). Плазмиды не связаны с бактериальной хромосомой, они могут реплицироваться независимо от нее, могут «выплевываться» бактерией в окружающую среду или, наоборот, из этой окружающей среды «проглатываться». С помощью плазмид бактерии обмениваются друг с другом генетической информацией, — например, передают соседям устойчивость к какому-нибудь антибиотику.
Рисунок 1. В бактериальной клетке наряду с бактериальной хромосомой плавает еще и множество плазмид.
рисунок автора статьи
Плазмиды существуют внутри бактерий в естественных условиях, поэтому никто не может помешать исследователю искусственно синтезировать плазмиду, которая будет обладать нужными для него свойствами, вшить в нее вставку (или несколько) и запустить в клетку. Плазмида — это, можно сказать, «болванка» для молекулярного биолога. Поэтому плазмиды стараются сделать как можно более универсальными и подходящими для всех случаев жизни.
Для того, чтобы из плазмиды получился рабочий вектор, она должна обладать некоторыми важными характеристиками.
Размножение
Прежде всего, плазмида обязательно должна в клетке размножаться, реплицироваться, потому что иначе она быстро подвергнется деградации, а вместе с ней исчезнет и ген-вставка. Для этого в ней должна быть специальная последовательность под названием «точка начала репликации», с которой и начинается удвоение ДНК. У разных видов живых существ эти точки имеют разную нуклеотидную последовательность. Поэтому, если мы хотим создать плазмиду, которая бы реплицировалась сразу в двух видах клеток (например, и в дрожжевых, и в бактериальных), то нам надо вставить в нее две точки начала репликации.
Разрезание
Кроме того, в ДНК плазмиды должны быть участки, в которых ее можно будет разрезать, чтобы вшить туда вставку. В качестве «ножниц» используются особые ферменты — рестриктазы. Они прекрасны тем, что режут ДНК не где попало, а в строго определенных местах, которые называются сайтами рестрикции (каждая рестриктаза распознает только свой сайт и только в нем (или возле него) разрезает ДНК). Обычно в плазмиду ставят множество разных сайтов рестрикции, расположенных в разных точках, — благодаря этому ее можно будет разрезать в нужном месте нужной рестриктазой. Участок ДНК, на котором собрано несколько сайтов рестрикции, называется полилинкером.
Селекция
Процесс, при котором бактерия «глотает» плазмиду, именуется трансформацией. В естественных условиях трансформироваться может в каждый момент времени не вся популяция бактерий, а только ее часть — компетентные клетки. Существуют лабораторные методы, с помощью которых можно искусственно увеличить количество компетентных клеток (некоторые из них описаны ниже в главе «Как засунуть вектор в клетки»), однако, все равно, стопроцентная компетентность для бактериальной культуры — вещь недостижимая.
Так что, добавляя плазмиду к бактериям, мы заранее должны смириться с тем, что бóльшая часть бактериальных клеток так и останется бесплазмидной, нетрансформированной. Поэтому нам придется отделять зерна от плевел, — то есть, трансформированные клетки от всех остальных. Для этого используется простой, но остроумный прием.
Допустим, мы встроили в нашу плазмиду ген устойчивости к какому-нибудь антибиотику (такой ген называется селективным маркером). Теперь клетки, которые «съели» плазмиду, будут неуязвимы для этого антибиотика и смогут спокойно жить в его присутствии. В результате, чтобы выделить из всех бактерий, к которым мы добавили плазмиду, те, которые смогли эту плазмиду использовать по назначению, нам достаточно будет добавить к бактериальной культуре соответствующий антибиотик. Те клетки, которые нам нужны, смогут существовать и делиться в присутствии этого антибиотика, а остальные этого делать не смогут.
Существуют и другие способы провести селекцию. Можно, например, поместить сайт рестрикции не внутрь гена антибиотика, а внутрь какого-нибудь «заметного» гена (скажем, такого, в присутствии которого бактериальные культуры меняют цвет). В результате можно будет отличить нужные колонии от ненужных просто на глаз, безо всяких манипуляций. По такому принципу работает, например, очень модная сейчас система бело-голубой селекции.
Если мы собираемся работать только на бактериях, то всем вышесказанным дело и ограничится. Однако если конечная наша цель — засунуть вектор в эукариотические клетки (например, клетки млекопитающих), то нам предстоит еще один этап селекции.
Дело в том, что в большинстве эукариотических клеток плазмиды живут недолго и быстро подвергаются деградации. Поэтому, даже если мы заставили клетку «съесть» плазмиду, не стоит питать надежды, что наша вставка теперь останется в этой клетке навсегда. Скорее всего, она успеет только немного поэкспрессироваться, прежде чем содержащий ее вектор будет пойман нуклеазой и разрезан на кусочки. Однако если вектор случайно смог встроиться в геном (это событие очень редкое, но не невероятное), то наша вставка, можно сказать, пустит в этой клетке корни — причем не только в ней самой, но и во всех ее потомках. И для того, чтобы выделить из всех клеток те, которые имеют вектор в своем геноме, нам понадобится еще один селективный маркер — ген устойчивости к какому-нибудь эукариотическому антибиотику (потому что бактериальные антибиотики, как правило, на клетки эукариот не действуют). Добавив соответствующий антибиотик (например, генетицин) к среде, в которой культивируются клетки, мы через некоторое время получим популяцию только тех клеток, в геноме которых сидит наш вектор.
Промоторы
Перед каждым рабочим геном находится короткий участок ДНК под названием промотор. Именно сюда прикрепляется фермент РНК-полимераза, который синтезирует РНК на матрице ДНК, что является первым и абсолютно необходимым этапом в экспрессии гена. Если у гена нет промотора, его экспрессию запустить невозможно, и он так и останется «молчащим». Можно сказать, что ген без промотора — это все равно, что машина без педали газа. Поэтому в нашей плазмиде обязательно должен быть хотя бы один промоторный участок, под контроль которого можно будет поставить ген-вставку.
А промоторы бывают разные.
Во-первых, они различаются по своей силе. Некоторые вызывают бурную транскрипцию подконтрольного гена, другие — совсем вялую.
Во-вторых, у прокариот и эукариот промоторы отличаются. Прокариотические промоторы не работают в эукариотических клетках и наоборот. Поэтому будет Ужасной Ошибкой поставить тот ген, который должен, экспрессироваться в бактериальных клетках, под эукариотический промотор — это все равно, что оставить его без промотора вообще.
В-третьих, у эукариот есть несколько типов РНК-полимеразы — они обеспечивают синтез различных видов РНК. И каждый тип РНК-полимеразы распознает только свои промоторы и «не видит» чужие. Поэтому, в зависимости от того, какую именно РНК кодирует наша вставка (например, матричную или, наоборот, шпилечную, а может, и вовсе рибосомальную), нам нужно подбирать и тип промотора, который мы будем ставить в плазмиду.
И, наконец, в-четвертых, разные промоторы включаются по-разному. Некоторые активны постоянно. Другие активизируются только при определенных условиях — например, при повышении окружающей температуры или появлении в клетке каких-то веществ. К тому же, у многоклеточных организмов в каждой ткани включены одни промоторы и выключены другие. Можно, например, подобрать такой промотор, который будет активен только в нейронах. Или только в нейронах головного мозга. Или только в нейронах головного мозга, относящихся к одному из подкорковых ядер. Или только в крохотной субпопуляции нейронов головного мозга, относящейся к одному из подкорковых ядер. И сужать этот круг можно почти до бесконечности.
Знание всего этого дает исследователю удивительную свободу. Подобрав в плазмиду подходящий промотор, он сможет творить с экспрессией гена-вставки почти все, что ему заблагорассудится. Ну, скажем, сделать так, чтобы он экспрессировался сильно, только в мышечных клетках и только в ответ на повышение температуры.
Трансляция белка
Засовывая вектор в клетку, ученый может хотеть двух разных вещей:
- чтобы происходила только транскрипция гена-вставки (то есть, синтез РНК на матрице ДНК — например, этого достаточно, если в клетку вносится какая-нибудь некодирующая РНК);
- чтобы происходила и транскрипция, и трансляция гена-вставки (то есть, экспрессия кодируемого вставкой белка).
В первом случае вектор называется транскрипционным, во втором — экспрессионным. Экспрессионные векторы обычно немного сложнее транскрипционных, потому что в них присутствуют:
- Консенсусная последовательность Козак. Это длинное имя носит короткий (примерно в 10 нуклеотидов) фрагмент в самом начале молекулы матричной РНК, который через белки-посредники обеспечивает связывание этой мРНК с рибосомой (без чего, как нетрудно догадаться, синтез белка невозможен). Последовательность Козак характерна только для эукариот, причем у представителей разных видов она немного отличается. Поэтому, создавая экспрессионный вектор, надо вставлять в него последовательность, которая характерна именно для того живого существа, в клетки которого мы собираемся вставлять вектор. Кроме того, последовательность Козак бывает сильной и слабой — то есть, приводящей к синтезу большого или малого количества белка. У прокариот роль последовательности Козак выполняет последовательность Шайна-Дальгарно, которая непосредственно (в смысле — без посредников, в отличие от последовательности Козак) соединяется с рибосомой, после чего и начинается синтез белка;
- Последовательность Козак находится перед вставляемым геном. А после него должны находиться еще несколько коротких участков, к которым присоединяются белки, выполняющие полиаденилирование — пришивание к концу свежесинтезированной РНК полиаденинового хвоста. Этот хвост выполняет несколько функций, в том числе, обеспечивает экспорт РНК в цитоплазму и помогает организации трансляции — то есть, если мы хотим обеспечить синтез белка на основе нашей РНК, нам без него не обойтись;
- мРНК, которая служит матрицей для синтеза белка, может быть транскрибирована только и исключительно РНК-полимеразой II типа. Поэтому нам нужно вставить в плазмиду именно тот промотор, который работает с этой РНК-полимеразой.
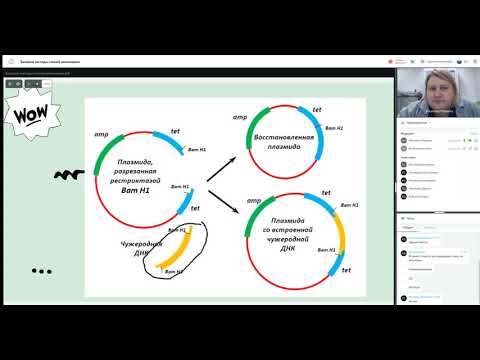
Итак, мы подобрали все необходимые для плазмиды кусочки. Но мало просто соединить их вместе — огромную роль играет их взаимное расположение. Например, сайты рестрикции должны быть не только многочисленны и разнообразны, но и находиться в «правильных» местах. При этом надо стараться, чтобы итоговая плазмида была как можно компактней, поскольку, во-первых, так она будет стабильнее, а во-вторых, охотнее «проглотится» клеткой. Одним словом, вы уже, наверное, поняли, что дизайн хорошей плазмиды — это тонкое и филигранное искусство (рис. 2).
Рисунок 2. Структура знаменитой плазмиды PBR322. В свое время это была, пожалуй, самая популярная плазмида во всем научном мире, а потом она стала основой для множества плазмид нового поколения. В ней есть участок начала репликации (ori), благодаря которому она может размножаться в клетках бактерии E. coli, гены устойчивости к двум антибиотикам — ампициллину (amp) и тетрациклину (tet), а также множество сайтов рестрикции (на самом деле их больше сорока, но здесь представлены только четыре — EcoRI, SalI, PstI, BamHI). Промоторные участки, к сожалению, не показаны, но они, разумеется, тут тоже есть. Некоторые сайты рестрикции находятся в генах устойчивости к ампициллину или тетрациклину, в результате чего и тот и другой сайт можно использовать в качестве второго селективного маркера. Например, если мы разрежем ген устойчивости к ампициллину с помощью рестриктазы PstI и вошьем в это место вставку, то тетрациклин будет первым селективным маркером, ампициллин — вторым, а селекция будет выглядеть так:
- Трансформируем бактерии, выращиваем их на среде с тетрациклином и выбираем только хорошо растущие клоны.
- Переносим эти клоны на среду с ампициллином и выбираем те, рост которых угнетается.
Если же мы вошьем вставку внутрь гена устойчивости к тетрациклину (разрезав его с помощью рестриктаз BamHI или SalI), то нам надо будет, наоборот, сначала посадить их на среду с ампициллином, а потом — с тетрациклином.
Плазмидные базы данных
За те несколько десятилетий, что существует методика молекулярного клонирования, были синтезированы тысячи разнообразных плазмид, из которых созданы базы данных (например, AddGene). В этих базах есть плазмиды на все случаи жизни — с разными типами точек начала репликации, разными полилинкерами, разными селективными маркерами и промоторами и так далее. Есть те, в которые можно вшить не одну вставку, а несколько, а есть даже такие, которые уже несут в себе некоторые особенно популярные вставки. Поэтому, как правило, исследователи не синтезируют плазмиду для клонирования самостоятельно, а покупают уже готовую. При необходимости купленную плазмиду можно «довести до ума», вставив или убрав определенные участки (а потом эту модифицированную плазмиду тоже добавить в базу данных). Иными словами, часто задача ученого сводится просто к тому, чтобы подобрать подходящую плазмиду.
Видео:Как работает генетическая инженерия.Скачать

Другие векторы
Плазмида — прекрасный вектор для относительно небольших вставок. Если ген-вставка слишком велик, то плазмида утрачивает стабильность, потому что ее участки начинают «перетасовываться» друг с другом и теряться при репликации, из-за чего она постепенно укорачивается. Поэтому в качестве вектора для длинных вставок используются более устойчивые конструкции. Например:
- Космида — гибрид плазмиды и фага (вируса, который заражает бактерии). По сути дела, это просто плазмида, в которую добавлены сайты для связывания с белками оболочки фага (они называются cos-сайтами, и именно благодаря им космиды получили свое название). Белковая оболочка делает космиду стабильнее, благодаря чему в нее можно загружать более длинные вставки;
- Искусственные хромосомы (человеческие, бактериальные, дрожжевые) — это сложные и крупные конструкции, являющиеся по сути микрохромосомами. Они относительно стабильны и при этом обладают гигантской емкостью: в них можно вставлять сразу несколько генов. Однако из-за огромных размеров их гораздо труднее засунуть в клетку;
- И, наконец, есть еще один вид векторов — вирусные. Этот вид настолько важен, что ниже ему будет посвящен целый раздел.
Видео:Изменить ДНК у себя дома? | DIY-биологияСкачать

Вставляем ген в плазмиду
Допустим, исследователь подобрал подходящую плазмиду и получил нужную вставку. Теперь нужно соединить одно с другим, чтобы затем засунуть в клетки. Для этого достаточно совершить несколько простых действий.
Как уже говорилось, в плазмиде существует несколько сайтов рестрикции — то есть, участков, в которых ее может разрезать нужная рестриктаза. Нам нужно выбрать подходящий сайт, который будет находиться в том месте, куда мы собираемся вшивать вставку, а затем обработать плазмиду соответствующей рестриктазой.
После этого той же рестриктазой нужно обработать вставку, поскольку рестриктазы обычно оставляют выступающие концы на одной из нитей ДНК, и эти концы должны быть совместимы у вставки и плазмиды, чтобы они согласились соединиться. Если на кончиках вставки нет нужных сайтов рестрикции, то можно приделать к нему короткие ДНК-фрагменты с нужными сайтами рестрикции на концах.
И наконец, нам нужно соединить в одной пробирке плазмиду и вставку (предварительно очищенные от рестриктаз) и добавить к ним ДНК-лигазу, которая умеет лигировать (то есть, сшивать воедино) две молекулы ДНК. Конечно, в результате мы получим не только желанный вектор, в котором плазмида соединена со вставкой (назовем его чеширским котом с улыбкой), но и целый коктейль побочных продуктов — пустую плазмиду (кота без улыбки), замкнутую вставку (улыбку без кота), несколько сшитых между собой вставок (много улыбок) и так далее. В ходе селекции эти ненужные продукты отсеются, и у нас в руках останется только вектор.
Видео:Биотехнология, ее направления. Клеточная и генная инженерия | Cериал CЕЛЕКЦ EDUCATION | ВебиумСкачать

Выделяем вектор
Итак, вначале мы проводим селекцию.
- Увеличиваем компетентность бактерий, добавляем к ним «коктейль», полученный в результате лигирования, а потом высеваем эти бактерии на среду с антибиотиком, который является нашим первым селективным маркером;
- Выбираем те бактериальные клоны, которые растут на среде с антибиотиком — они смогли съесть плазмиду со вставкой или хотя бы просто плазмиду (кота — с улыбкой или без);
- Проводим с этими клонами второй этап селекции, в зависимости от того, какой ген мы использовали в качестве второго селективного маркера. Например, если этот ген — устойчивость к другому антибиотику, то мы переносим бактерии на среду с этим антибиотиком и выбираем те клоны, рост которых угнетается, — они ухитрились проглотить не просто плазмиду, а плазмиду, в которую была вшита вставка (кота с улыбкой);
- Выращиваем полученную культуру бактерий.
И вот мы получили ее — бактериальную культуру, в которой живет созданный нами вектор. Вполне возможно, что это и было нашей конечной целью, и теперь мы, спокойные и счастливые, можем, например, включить в бактериях экспрессию гена-вставки и пожинать урожай синтезированных в результате белков.
Но если нам нужен чистый вектор, который можно будет потом засовывать в другие клетки, то у нас появляется проблема, которая кажется неразрешимой. Как вызволить вектор из бактерий? Ведь даже если мы выделим из этих бактерий ДНК, то помимо вектора получим еще и совершенно ненужную нам бактериальную хромосому.
Тут можно воспользоваться тем, что плазмидная ДНК имеет важные отличия от хромосомной: она, во-первых, гораздо меньше по размеру, а во-вторых, гораздо больше суперскручена. Поэтому можно подобрать такие условия, в которых бактериальные хромосомы будут осаждаться, в то время как плазмиды останутся плавать в растворе. Достаточно будет отцентрифугировать получившийся осадок (чтобы вся бактериальная ДНК прочно «упала на дно»), а затем уже из надосадочной жидкости выделить нашу плазмиду (обычно для этого используются специальные колонки, которые очень облегчают и ускоряют работу).
Видео:Свойства плазмид и их использование в генетическом клонировании. 11 класс.Скачать

Как засунуть вектор в клетки
И вот наступил желанный миг. Исследователь держит в руке пробирку, в которой плещется прозрачная жидкость — столькими трудами полученный вектор. И тут перед ним встает преграда. Клетки, в которые он собирается засунуть свой вектор, отказываются его глотать.
Дело в том, что липидная мембрана, которой окружены клетки, обладает избирательной проницаемостью — то есть, она пропускает через себя одни частицы и не пропускает другие. Крупные заряженные молекулы (а именно таковой и является ДНК) через эту мембрану самопроизвольно пройти не могут. И если бактерии, например, умеют проглатывать плазмиды из внешней среды (как уже было сказано выше), то, скажем, клетки животных к этому совершенно не склонны. Поэтому для того, чтобы засунуть в клетку вектор, исследователю приходится прибегать ко множеству хитростей, о которых и будет сейчас рассказано. Но сначала — немного терминов.
Для внесения в клетку вектора есть несколько обозначений в зависимости от того, какой используется вектор и в какие клетки он вносится.
- Трансформация (о которой уже было немного рассказано) — это внесение плазмид (и других невирусных векторов) в бактерии, а также клетки растений и грибов;
- Трансфекция — то же самое, что и трансформация, но только в применении к клеткам животных;
- И, наконец, трансдукция — это внесение в любые клетки вирусного вектора.
Эти термины, в общем, не очень строгие. Например, даже в некоторых солидных статьях трансдукцию иногда называют вирусной трансфекцией (а то и просто трансфекцией).
Вещества-проводники
Самый простой и очевидный путь внесения в клетку генетического материала — соединить вектор с каким-нибудь переносчиком, у которого нет проблем с проникновением через мембрану, и позволить получившемуся комплексу пролезть внутрь клетки. Это не отнимает много времени и не требует дорогостоящего оборудования. Такой способ обычно называют химической трансфекцией. В этом случае события развиваются по следующему сценарию:
- Вектор соединяется с переносчиком;
- Получившийся комплекс проглатывается клеткой и оказывается в цитоплазме;
- В цитоплазме комплекс разваливается и вектор высвобождается;
- Вектор проникает в ядро и выполняет свое предназначение (скажем, с него начинает транскрибироваться мРНК).
К сожалению, почти на каждом из этих этапов возникают трудности. Во-первых, клетки захватывают далеко не все плавающие вокруг них комплексы. Во-вторых, не факт, что, оказавшись внутри клетки, вектор отделится от переносчика — вполне возможно, что они так и будут в обнимку плавать в цитоплазме, пока не подвергнутся деградации. В-третьих, даже если какой-то редкий комплекс умудрился проникнуть в клетку и там развалиться, это означает, что помимо вектора в клетке оказывается еще и переносчик, который может быть токсичен, вызывать побочные эффекты и вообще «замыливать» результаты экспериментов. И, наконец, в-четвертых, только небольшая часть вектора, оказавшегося внутри клетки, сможет проникнуть в ядро. Иными словами, комплексы вектора с переносчиком надо добавлять к клеткам в огромном избытке, чтобы хотя бы маленькая часть из них выполнила свое предназначение.
Утешает то, что среди производителей веществ-переносчиков огромная конкуренция, и поэтому на рынке постоянно появляются новые составы с улучшенными свойствами, которые минимизируют вышеописанные трудности. У каждого из составов есть какая-то своя «фишка», которая дает ему преимущество в конкурентной борьбе — некоторые образуют с вектором такие компактные комплексы, которым гораздо легче пробраться внутрь клетки; другие эффективнее отделяются от вектора, оказавшись в цитоплазме; третьи более универсальны и работают на огромном количестве типов клеток; четвертые, наоборот, славятся своей избирательностью и проникают только в те клетки, которые, например, экспрессируют какой-то специфический рецептор. Одним словом, если исследователь решил засунуть вектор внутрь клетки с помощью химической трансфекции, то ему просто надо выбрать из множества составов, представленных на рынке, тот, который будет лучше работать в данном конкретном случае.
Дырки в мембране
Но некоторые клетки так привередливы и капризны, что в принципе не соглашаются глотать комплексы ДНК с переносчиком (таким скверным характером славятся, например, первичные клетки — то есть, те, которые не выращивались в культуре, а были получены непосредственно от живого организма). Чтобы ввести в эти клетки генетический материал, ученому приходится прибегать к грубой силе — продырявливать мембрану и засовывать ДНК в образовавшиеся отверстия. Этот жестокий подход называется физической трансфекцией; он очень травматичен для клеток, и только некоторые из них переживут столь неделикатное обращение. Поэтому применять данную методику стоит, только если вы точно уверены, что обладаете достаточным количеством клеток и можете пожертвовать бóльшей частью из них. Ну и к тому же, вам потребуется довольно дорогое оборудование.
Наверное, самый распространенный способ продырявливания мембраны называется электропорацией. Дело в том, что у клеток, попавших в электрическое поле, в мембране возникают отверстия (которые получаются тем больше, чем сильнее приложенное к клеткам поле). Если эти отверстия малы, то клетка сможет «залечить» их; если же они слишком велики, то клетка погибнет из-за необратимого нарушения целостности мембраны. Поэтому эмпирическим путем можно подобрать оптимальную величину поля для того, чтобы клетки, с одной стороны, продырявились, а с другой — остались в живых. А когда клетки продырявлены, то добавленный к ним вектор проникает сквозь отверстия и оказывается в цитоплазме.
Кроме электропорации, есть еще несколько способов — экзотических и не очень — сделать в мембране дырки. Например, с помощью:
- Ультразвука (это называется сонопорация);
- Лазера (оптическая трансфекция);
- Нанопроволоки с пришитым к ней вектором, которая физически прокалывает мембрану (импалефекция);
- Магнитных взаимодействий (магнитофекция или магнитная трансфекция). В этом случае вектор присоединяется к магнитным наночастицам, которые транспортируются внутрь клетки с помощью магнитного поля.
Ну и наконец, для самых непокорных клеток, которые не поддаются никакой из вышеописанных методик, существует прибор под названием «генная пушка». Генная пушка расстреливает упрямые клетки частичками металла (обычно используется золото) с присоединенным к ним вектором. (Источником вдохновения для изобретателей этого прибора послужил пневматический молоток.) Генная пушка подходит практически для всех типов клеток, включая растительные, окруженные твердой клеточной стенкой, которая является практически непреодолимой преградой для большинства других методик.
А вообще, почти все вышеописанные методики дают более-менее похожие результаты на большей части типов клеток, а приборы для них стоят дорого. Поэтому, как правило, лаборатория покупает прибор для какой-то одной методики, и дальше уже по этой методике и доставляет генетический материал в клетки.
Видео:Генная инженерия. Изменит все и навсегда.Скачать

Овечки в волчьей шкуре
Зачем придумывать новые и трудные пути засовывания в клетку нуклеиновых кислот, если можно воспользоваться теми элегантными способами, которые за время долгой эволюции изобрели существа (или, возможно, вещества; нельзя точно сказать, живые они или нет), для которых транспортировка своего генетического материала внутрь клетки является необходимой фазой жизненного цикла? Все, наверное, уже догадались, что речь идет о вирусах.
Вирусы — это молекулы ДНК или РНК, упакованные в белковую оболочку (а иногда завернутые в липидный слой со встроенными в него вирусными белками). Именно оболочка играет главную роль в проникновении вируса через клеточную мембрану. Поэтому если засунуть в эту оболочку невирусную нуклеиновую кислоту, то она, будто вирус, тоже сможет попасть в клетку — как овечка, одетая в волчью шкуру. На этом принципе и основано использование вирусных векторов. Пожалуй, вирус — это самое эффективное транспортное средство для доставки в клетку генетического материала. Но приготовление вирусных векторов очень хлопотно, долго и трудоемко. Да вы сейчас и сами увидите.
Итак, чтобы сделать вирусный вектор, нужно для начала подобрать подходящий вирус. Идеальный кандидат:
- Стабилен — то есть, не склонен к спонтанным геномным перестройкам;
- Ёмок — то есть, может вместить в себя даже самую большую вставку;
- Не влияет на жизнедеятельность клетки;
- Не вызывает иммунного ответа;
- Встраивает свой геном не в первое попавшееся место генома хозяина (это может привести к непредсказуемым последствиям и вообще «замылить» результаты экспериментов), а в какую-нибудь определенную точку (а еще лучше — в точку, заданную самим исследователем);
- И обладает другими симпатичными чертами.
К сожалению, идеал недостижим, и ученым приходится выбирать из того, что есть. А именно:
Ретро
Ретровирусы долгое время были самой популярной основой для векторов. Это РНК-содержащие вирусы, которые, оказавшись в клетке, синтезируют ДНК на основе своей РНК с помощью ревертазы (собственно, поэтому они и называются «ретро», ведь синтез ДНК на основе РНК — это, в каком-то смысле, шаг назад). Ретровекторы хорошо выполняют свое предназначение, то есть, стабильно доставляют в клетку заключенный в них генетический материал, но у них есть несколько недостатков, из-за которых работать с ними неудобно.
Во-первых, они все (за одним исключением, о котором скоро будет рассказано) способны инфицировать только делящиеся клетки. Поэтому если исследователь, например, собрался изучать нейроны, которые не склонны к делению, ему надо забыть о ретровекторах и начать искать что-нибудь другое.
Во-вторых, ретровирусы встраиваются в самые непредсказуемые участки генома, каждый раз разные, и это приводит к самым непредсказуемым последствиям. Для начала, из-за этого нарушается воспроизводимость экспериментов — но это еще ладно. Беда в том, что ретровектор может вклиниться в середину какого-нибудь важного гена, из-за чего этот ген выключится, а в клетке начнутся патологические изменения, которые могут довести ее до гибели. Или, наоборот, ретровектор может случайно включить какой-нибудь совершенно ненужный ген, например, онкоген, что также приведет к очень печальным результатам (особенно если исследования проводятся не на культуре клеток, а на живом организме, и особенно если этот организм — человеческий).
Эти недостатки отвратили сердца ученых от ретровекторов и заставили их искать что-нибудь более подходящее. И найти кое-что замечательное удалось прямо внутри ретровирусного семейства.
Ленти
Лентивирусы — это род ретровирусов, который отличается от прочих представителей своего семейства некоторыми приятными с точки зрения молекулярного клонирования чертами.
Прежде всего, лентивирусы умеют заражать не только делящиеся, но и неделящиеся клетки. Эта особенность ужасна с точки зрения врача, который лечит вызванное лентивирусом заболевание, и прекрасна с точки зрения молекулярного биолога, который делает на основе лентивируса лентивектор. Ведь работая с таким вектором, ученый сможет использовать гораздо более широкий ассортимент клеточных типов, а значит, сделать гораздо больше великих открытий.
Плюс к тому, лентивекторы довольно емкие, то есть, они способны вместить в себя крупные вставки. Отчасти это связано с тем, что из их генома в целях безопасности выкидывается бóльшая часть, и в результате освобождается куча места. Ну и кроме того, лентивирусы встраиваются в чуть менее непредсказуемые участки генома, чем прочие ретровирусы, а это тоже очень здорово.
«Ленти» по латыни значит «медленный». Это слово очень точно отражает характер лентивирусов — они вызывают заболевания с необычайно длинным инкубационным периодом. Вирус СПИДа — это тоже, кстати, лентивирус.
Адено
Аденовирусы, наряду с ретровирусами, долго были самой популярной основой для векторов, но теперь потихоньку сдают свои позиции. Аденовирусы способны заражать не только делящиеся, но и неделящиеся клетки; ассортимент клеточных типов, которые они заражают, довольно широк. Но они не встраиваются в хозяйский геном, и поэтому подходят не для всех экспериментов. Кроме того, аденовирусы часто вызывают сильный иммунный ответ. Поэтому все чаще они используются не в базовых исследованиях, а для всяких прикладных целей — например, для создания вакцин.
И наконец, относительно недавно на сцене появился новый персонаж, который сразу расположил к себе ученых множеством чудесных качеств. Зовут его аденоассоциированный вирус (AAV).
AAV ведет себя настолько тихо, скромно и ненавязчиво, насколько этого вообще можно ждать от вируса. Практически единственное, что он делает, оказавшись в клетке, — это встраивается в хозяйский геном, причем почти всегда не в первое попавшееся, а в строго определенное место. Он, судя по имеющимся сейчас данным, не вызывает никаких заболеваний, поэтому и иммунный ответ на него очень слабый. К тому же, он способен заражать и делящиеся, и неделящиеся клетки. Одним словом, AAV — просто идеальная основа для вектора, хотя и он не лишен некоторых недостатков. И главный его недостаток — малая емкость. В AAV-вектор могут влезть только совсем небольшие вставки, и в этом он очень проигрывает, например, лентивекторам.
Кроме того, AAV — дефективный, несамостоятельный вирус. Он может размножаться только в клетках, которые уже заражены аденовирусом (что и отражено в его названии). Это совсем неплохая черта, если мы хотим заразить нашим вектором культуру клеток; но если мы собираемся делать вектор для генной терапии (методики лечения генетических (и не только) заболеваний, при которой организм заражается вирусным вектором, несущим необходимые этому организму гены), то такая дефективность будет нам очень мешать, потому что вирусы не смогут как следует распространяться по организму. Однако сейчас эта проблема решена, и разработаны AAV-векторы, которые способны размножаться сами по себе, безо всякой помощи.
Но вот подходящий вирус подобран. Теперь начинаются игры с его геномом.
- Вначале нам нужно освободить в этом геноме место — то есть, выкинуть из него какие-то гены. Обязательно нужно оставить те участки, на которые налипает оболочка (чтобы наш вектор был полноценным, «одетым» вирусом), и те гены, которые обеспечивают встраивание вирусного генома в геном хозяйской клетки (чтобы он мог выполнить свое предназначение); при этом от других областей — например, генов белков оболочки — мы можем с чистой совестью избавиться;
- Из получившегося «огрызка» генома делается плазмида — вставляются фрагменты, о которых уже было рассказано выше (точки начала репликации, селективные маркеры и так далее). В принципе, такие плазмиды уже есть в плазмидных базах данных, и, как правило, задача исследователя сводится к тому, чтобы подобрать подходящую;
- В эту плазмиду вшивается необходимая вставка (со всеми прелестями многоэтапной селекции, которые были описаны выше).
Теперь у нас возникает небольшая проблема. Даже засунув эту плазмиду в клетку, никаких вирусов мы не получим, потому что мы уже выкинули (в пункте 1) те гены, которые нужны для их создания. Поэтому нам придется пойти на маленькую хитрость.
Мы засунем в клетки не одну плазмиду, а две. Первая, основная (назовем ее Пу), — это та, которую мы получили в пункте 3. А вторая, вспомогательная (назовем ее Ме), будет нести гены, которые мы выкинули в пункте 1. Обе плазмиды начнут размножаться в хозяйской клетке. Плазмида Ме будет экспрессировать свои белки — например, белки оболочки и белки, необходимые для самосборки вирусов. Поскольку на Пу есть участки для налипания белков оболочки, то эти белки на нее и налипнут, и в результате мы получим вирус с необходимыми генами внутри, чего мы и добивались.
Итак, наш план действий таков:
- Подбираем какие-нибудь клетки, которые хорошо поддаются трансфекции (такая линия клеток называется «упаковывающей»; обычно это линия эмбриональных клеток человеческой почки НЕК293) и засовываем в них сразу две плазмиды — Пу и Ме, основную и вспомогательную;
- Ждем некоторое время (около двух дней), чтобы успели образоваться вирусы. После этого собираем среду, в которой живут клетки, — вирусы плавают в ней;
- Очищаем полученные вирусы (как правило, для этого используется центрифугирование и фильтрация) и.
- Используем их по назначению, то есть, заражаем ту линию клеток, на которой собираемся проводить эксперименты.
Это, конечно, только общая схема, у каждого конкретного вектора есть свои нюансы. Например, бывает, что вместо одной вспомогательной плазмиды используют две или даже три. При создании некоторых AAV-векторов упаковывающие клетки нужно заразить аденовирусом. А если мы создаем вектор для генной терапии, который должен уметь размножаться в хозяйской клетке и заражать ее соседей, то нам придется гораздо аккуратнее обращаться с вирусным геномом и расчищать в нем место с большой осторожностью, чтобы не нарушить способность вирусов к самостоятельному размножению. И так далее.
Видео:Просто о генной инженерииСкачать

Последний шаг
Итак — ура! — тем или иным способом мы все-таки умудрились засунуть вектор в клетки. Нам остается последний шаг — нужно выбрать из всех клеток те, которые встроили векторную ДНК в свой геном.
Собственно, для этого мы и добавили в вектор последний селективный маркер — ген устойчивости к антибиотику, работающему на эукариотических клетках. Мы просто будем постоянно добавлять этот антибиотик в среду, в которой находятся наши клетки, — в результате останутся в живых и смогут делиться только те, которые имеют в геноме этот ген и всю нашу векторную ДНК впридачу.
Все! Клонирование завершено. Мы получили линию генетически модифицированных клеток, в геноме которых присутствует наша вставка. Пришло время проводить с этими клетками необходимые эксперименты.
Видео:Сергей Дмитриев. Генная инженерия.Скачать

Генная инженерия бактерий: как внести нужные нам гены в составе плазмидного вектора в бактерию
Итак, у нас на руках есть плазмидный вектор и есть подходящий для данного вектора штамм бактерии, осталось внести вектор в бактерию.
В предыдущей статье упоминалась работа Фредерика Гриффита, которая наглядно демонстрирует тот факт, что ДНК может самопроизвольно проникать в бактериальные клетки. Способность бактериальной клетки поглотить находящуюся в окружающей среде молекулу ДНК называется «компетентность» (что рождает большой простор для шуток на тему того, что даже одноклеточные в пробирке компетентны, а твой коллега по лаборатории нет). Если поглощение происходит не под влиянием каких-то искусственно созданных условий, то мы говорим о «естественной компетентности». Как происходит подобный транспорт ДНК внутрь бактерии?
1) Строение клеточной оболочки бактерий
Для начала рассмотрим вкратце строение оболочки грамположительных и грамотрицательных бактерий.
Оболочка грамотрицательной бактерии состоит из двух липидных бислоёв: внешней мембраны и внутренней мембраны (внутреннюю ещё называют плазматической). Между ними находится периплазматическое пространство, заполненное выполняющими важные функции белками и пептидогликаном.
Слева — строение оболочки грамотрицательной бактерии. Цветные штуковины внутри мембран это мембранные белки, а торчащие наружу цепочки — липополисахариды. Справа — строение самой грамотрицательной бактерии.
Пептидогликан — это гетерополимер, состоящий из ковалентно сшитых N-ацетилглюкозамина (NAG) и N-ацетилмурамовой кислоты (NAM). Получается цепочка . -NAG-NAM-NAG-NAM-NAG-…. «Гетеро» в слове «гетерополимер» означает, что полимер состоит не из одних и тех же элементов (как полиэтилен), а из двух разных. Синтезирующий пептидогликан фермент транспептидаза является мишенью для β-лактамных антибиотиков (пенициллиновые антибиотики и цефалоспорины): они подавляют его активность, в результате в процессе деления бактерии не образуется достаточного для обеих дочерних клеток количества пептидогликана. Также пептидогликановый слой является мишенью для фермента лизоцима: он разрушает ковалентную связь между NAG и NAM. В медицине лизоцим используется в качестве антисептика, например, он является активным компонентом некоторых препаратов для лечения больного горла, а в пищевой промышленности его могут использовать в качестве консерванта (пищевая добавка E1105 — это и есть лизоцим).
Пептидогликан. На рисунке изображена часть, соответствующая одному NAG (он слева) и одной NAM (она справа), которые соединены между собой через атом кислорода. (Для тех, кто не любит такие вольности в химии: эта «связь через атом кислорода» называется β-(1,4)-гликозидной).
Оболочка грамположительных бактерий состоит только из внутренней (плазматической) мембраны, очень тонкого периплазматического пространства и внешнего, более толстого, чем у грамотрицательных бактерий слоя пептидогликана.
Подобные препятствия, стоящие на пути любого соединения в бактериальную цитоплазму являются непреодолимыми для всего, кроме воды, а также небольших неполярных и гидрофобных молекул (молекулярные кислород и азот, углекислый газ и другие). Проникновение данных соединений через оболочку называется «пассивный транспорт» («простая диффузия»), он всегда происходит по градиенту концентрации. Неполярные молекулы способны свободно проходить через мембраны потому, что внутренний объём мембран также неполярен (внутри мембраны состоят из гидрофобных остатков жирных кислот), а неполярные соединения хорошо растворяется в неполярных растворителях (спирт, ацетон, жирные кислоты).
Шуточная картинка, на которой обыгрывается гидрофобность (водобоязнь) остатков жирных кислот, находящихся внутри двухслойной мембраны.
В свою очередь крупные полярные молекулы (аминокислоты, моносахариды, нуклеотиды), заряженные частицы (ионы) и макромолекулы (ДНК, белки) проникнуть через клеточную оболочку просто так не могут, так как они хорошо растворимы только в полярных растворителях (например, в воде). Тогда как молекулы ДНК попадают внутрь бактериальной клетки?
2) Механизмы индуцированного транспорта соединений в клетки из внешней среды
Прежде всего у нас на руках есть очевидный факт, что бактерия не может прожить только на воде, кислороде и углекислом газе, для жизнедеятельности ей нужны многие другие соединения. Значит есть и способы доставки этих соединений внутрь клетки. Такими способами являются «облегчённая диффузия» и «активный транспорт».
2.1) Облегчённая диффузия
Примером облегчённой диффузии (хотя этот конкретный случай наоборот для бактерии вреден) является транспорт ионов калия через оболочку бактериальной клетки в комплексе с валиномицином — антибиотиком, который синтезируется некоторыми грибами. Свободный валиномицин не может проникнуть внутрь клетки, так как у него наружу экспонированы полярные группы. Иону калия также «путь закрыт».
Скульптура, изображающая трёхмерную структуру комплекса валиномицина и иона калия (ион изображён в виде шара в центре). Установлена перед входом в Институт биоорганической химии РАН имени М. М. Шемякина и Ю. А. Овчинникова (Москва), в котором был установлен механизм антибактериальной активности валиномицина и трёхмерная структура его комплекса с ионом калия.
Зато после образования комплекса валиномицина с ионом калия он изменяет свою трёхмерную структуру таким образом, что вся его внешняя поверхность становится гидрофобной (неполярной), а все гидрофильные группы спрятаны внутри. Ион калия при этом спрятан внутри молекулы валиномицина, поэтому комплекс «валиномицин+ион калия» может проникнуть через мембрану. Комплекс может распасться на свободный валиномицин и ион в любой момент как внутри клетки, так и снаружи, но в целом облегчённая диффузия ионов приводит к уравниванию их концентрации как во внутриклеточном, так и во внеклеточном пространстве, а клетка неспроста контролирует транспорт ионов: высокая их концентрация губительна. Именно на этом и основан антибактериальный эффект валиномицина.
Схематичное изображение грибкового антибиотика валиномицина, образовавшего комплекс с ионом калия.
Другим примером могут служить неконтролируемые поры, которые представляют собой большие трансмембранные белки, позволяющие определённым веществам беспрепятственно проходить через мембрану согласно градиенту. Примером такой трансмембранной поры может служить α-токсин золотистого стафилококка Staphylococcus aureus (другое название токсина: α-гемолизин. Оно состоит из частей «гемо» и «лизин». «Гемо» — значит мишенью токсина являются клетки крови эритроциты; «лизин» — от слова «лизис», то есть «клеточная смерть»)
Трёхмерная структура олигомера α-гемолизина — токсина бактерии Staphylococcus aureus. На рисунке слева хорошо видна пора.
Основной функцией α-гемолизина в патогенном процессе является создание некотролируемых каналов в мембране клетки, которые в зависимости от окружающих условий могут пропускать моновалентные ионы, ионы кальция или АТФ. Как было указано выше, ионный дисбаланс крайне токсичен, а транспорт АТФ из клетки является вредным, так как АТФ — это незаменимое звеном почти всех химических процессов любой клетки.
2.2) Активный транспорт
Как видно из приведённых выше примеров, облегчённая диффузия не требует затрат энергии. Напротив, активный транспорт — это поглощение или выделение чего-либо клеткой с затратой энергии на каждый акт переноса. Это может быть транспорт крупных полярных молекул или ионов, причём транспорт ионов может осуществляться как по градиенту концентрации, так и против него. Разумеется, активный транспорт — это контролируемый процесс, в котором участвует целый набор внутриклеточных и трансмембранных белков. Таким образом, сначала клетке нужно затратить ресурсы на то, чтобы синтезировать все эти белки, а затем ещё раз затратить энергию на использование этой транспортной системы.
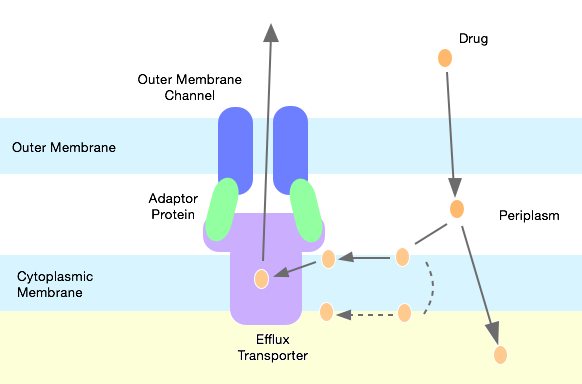
Примером активного транспорта может служить система энергозависимого транспорта гидрофобных и амфифильных соединений из клетки обратно в окружающую среду (эффлюкс).
Система активного транспорта антибиотика из бактериальной клетки наружу, состоящая из трёх белков, образующих единый трансмембранный комплекс. На рисунке отражён тот факт, что белок efflux transporter (фиолетовый) может «ловить» молекулы лекарств как непосредственно в цитоплазме, так и в мембране.
Эта система представляет особый интерес потому, что она является причиной мультирезистентности некоторых бактерий к антибиотикам: клетка избавляется от них до того, как они смогут ей серьёзно навредить. При этом более половины случаев мультирезистентности синегнойной палочки Pseduomonas aeruginosa связанны именно с активным транспортом антибиотиков. Что ещё более важно, уже обнаружены системы активного эффлюкса «новых» антибиотиков, которые применяются против бактерий, резистентных к широко используемым антибактериальным препаратам. Например, используемый при неэффективности классических антибиотиков препарат Линезолид выбрасывается обратно системой эффлюкса на основе белков AcrAB и TolC. Интересен ещё и тот факт, что умная бактерия не тратит силы на крупномасштабный синтез белков системы эффлюкса в тех ситуациях, когда они не нужны. Но как только появляются вредные для клетки вещества синтез стремительно активизируется и бактерия начинает активно сопротивляться. К слову, эффлюкс это не единственный механизм защиты бактерий от антибиотиков, про остальные способы я тоже как-нибудь напишу статью.
Структура линезолида — антибиотика, применяемого против устойчивых штаммов грамположительных бактерий.
3) Компетентность бактериальных клеток
Итак, мы рассмотрели механизмы трансмембранного транспорта соединений, которые не могут проникнуть через этот барьер без посторонней помощи. В естественных условиях транспорт ДНК в бактерию осуществляется только посредством активного транспорта за счёт кооперации целого спектра как внутриклеточных, так и трансмембранных белков. Неиндуцированная способность клетки поглощать ДНК извне называется «естественной компетентностью».
3.1) Естественная компетентность бактериальных клеток
Наиболее обоснованной гипотезой возникновения естественной компетентности бактерий является предположение, согласно которому данный механизм позволяет бактериям выживать в экстремальных для них условиях (экстремальные для клетки условия называют «стресс»). Дело в том, что стресс зачастую приводит к повреждениям «хромосомной» ДНК бактерии и если клетка хочет выжить, то ей нужно как-то «ремонтировать» свою «хромосому» (такой «ремонт» называется «репарация»). При этом известно, что если ввести в клетку последовательность ДНК, схожую с некоторым участком собственной ДНК клетки, то она с высокой вероятностью встроит этот «новый» кусок в свой геном. Что происходит при стрессовых условиях? Какие-то клетки гибнут, становясь донорами ДНК для тех своих собратьев, которые ещё борются за жизнь. Действительно, в пределах одной бактериальной культуры очень велика вероятность того, что геномы представителей очень схожи, поэтому выжившие бактерии могут использовать ДНК погибших сородичей для репарации своего генома.
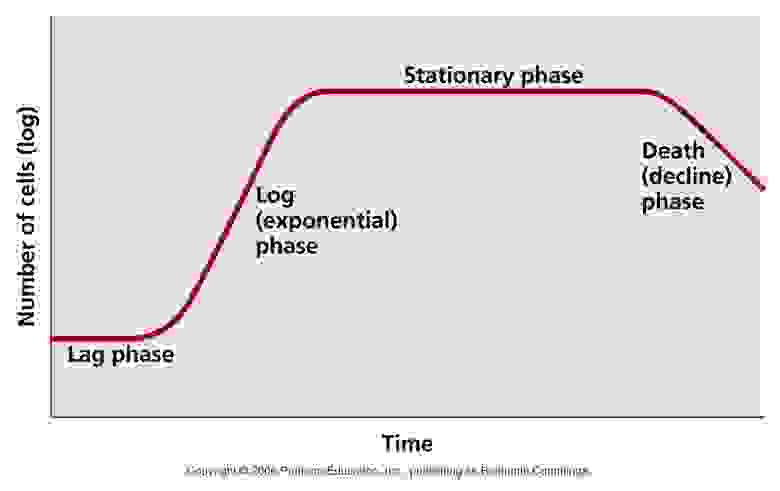
При этом в комфортных условиях в культуре клеток лишь часть из них обладает естественной компетентностью, а доля компетентных клеток от общего их числа является наибольшей тогда, тогда культура находится в определённой фазе роста — log-фазе.
Типичный график зависимости количества бактерий в культуре от времени. Log-фаза — это фаза роста, за которой следует выход на плато и стадия угасания, на которой клеткам уже не хватает питательных веществ и накапливаются токсины.
Конечно, исследователю хотелось бы сделать процесс переноса плазмидного вектора внутрь клетки как можно более эффективным: чем эффективнее процесс трансформации, тем меньше нужно плазмидного вектора для того, чтобы гарантировать хорошие результаты. Поэтому в лабораторных условиях обычно не надеются на саму клетку, а вместо этого создают клетки с искусственной компетентностью.
3.2) Искусственная компетентность бактериальных клеток
Существует два основных метода создания искусственной компетентности бактерий: обработка клеточной культуры двухвалентными ионами с последующим кратковременным нагреванием и так называемая электропорация.
3.2.1) Обработка клеточной культуры двухвалентными ионами с последующим кратковременным нагреванием.
Как правило в лаборатории есть холодильник с температурой около -80 градусов по Цельсию (иногда их у нас по аналогии с «ксероксами» называют «кельвинаторами» в честь одной из фирм-производителей), забитый пробирками с клетками, находящимися в log-фазе. Это сделано для того, чтобы не тратить время на их создание каждый раз, когда они необходимы (а времени это занимает довольно много, быстрее, чем за сутки их сделать не получится). А чтобы во время хранения клетки не погибли из-за заморозки в среду добавляют криопротекторы: глицерол, пропиленгликоль или диметилсульфоксид.
Лабораторный холодильник в представлении автора рисунка.
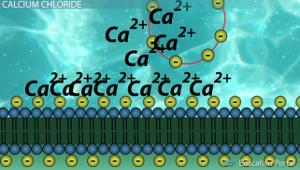
Когда исследователю нужно трансформировать определённый штамм он достаёт клетки из кельвинатора и помещает пробирку в лёд. Затем к находящимся в log-фазе роста клеткам добавляют двухвалентные катионы и нужный нам плазмидный вектор. Пробирка при этом не должна покидать лёд. Типичным донором таких катионов выступает хлорид кальция (CaCl2), в данном случае нашим двухвалентным катионом является Ca2+. Однозначного объяснения того, как Ca2+ помогает ДНК проникать внутрь бактерии нет:
- Некоторые источники утверждают, что высокие концентрации Ca2+ служат причиной образования брешей в оболочке клетки и повреждений ДНК, а ранее мы установили, что повреждение ДНК это сигнал для клетки переходить в компетентное состояние;
- По другим источникам данные ионы служат «мостиком», который прикрепляет плазмидный вектор к клетке. Дело в том, что положительно заряженные ионы присоединяются одновременно и к отрицательно заряженным группам полисахаридов на внешней мембране бактерий, и к отрицательно заряженным группам плазмидной ДНК. Если бы в среде не было ионов, то ДНК бы отталкивалась от клетки, а исследователю это совершенно ни к чему.
Вполне возможно, что обе гипотезы верны.
Предполагаемый механизм участия ионов Ca2+ при трансформации. Сначала ионы присоединяются к отрицательно заряженным группам ДНК (жёлтые круги) и заякоренных в мембране полисахаридов (жёлтые круги). Затем за счёт иона образуется своего рода мостик «полисахарид(-)» — «ион Ca(2+)» — «ДНК(-)», который закрепляет ДНК на поверхности клетки.
После инкубации бактерий при околонулевой температуре производится так называемый тепловой шок (heat shock) — кратковременное нагревание культуры до 42 градусов. Обычно продолжительности температурной обработки составляет 30-45 секунд, после чего пробирка с бактериями возвращается в ледяную баню (при более продолжительном тепловом шоке клетки могут погибнуть). Возможными причинами эффективности теплового шока являются те же механизмы: высокая температура может нанести повреждения ДНК и белкам (это индуцирует компетентность), а также может создать «пробоины» в оболочке клетки, через которые внутрь проникнут прикреплённые к мембране через ионы кальция плазмидные векторы.
Затем клетки высевают на чашки Петри с селективной средой и на них вырастают колонии.
3.2.2) Электропорация
Основой метода электропорации является тот факт, что электрическое поле может повредить клеточную оболочку. То есть дословно электропорация — это создание пор электрическим полем.
Сначала в специальную пробирку (кювету) помещают бактерии и плазмидный вектор. Затем кювету ставят в специальное устройство, которое на долю секунды создаёт разность потенциалов 0,1-10 кВ, что в свою очередь приводит к обратимому повреждению мембран и векторы могут свободно проникнуть в клетки. Через некоторое время бактериальную культуру высевают на чашки Петри с селективной средой.
Важным требованием к жидкой среде, в которой находятся клетки и вектор в момент электропорации является низкая концентрация ионов: в противном случае возможно короткое замыкание.
Послесловие
Каждая колония на чашке — это размножившиеся потомки одной единственной бактерии (то есть если мы на чашке видим 100 колоний, то это значит, что изначально было 100 жизнеспособных бактерий, которые затем начали делиться). После того, как на чашках появятся колонии исследователь выбирает одну из колоний и переносит клетки из колонии в новую селективную жидкую питательную среду. После того, как новая клеточная культура «подрастёт» её опять высаживают на новую чашку с той же самой селективной питательной средой. В итоге мы получаем чашку, на которой растут только потомки бактерий из одной единственной колонии (то есть по сути все они являются клонами одной единственной бактерии). И только эти клетки уже будут использоваться в дальнейшем для получения нужного нам белка в больших объёмах жидкой селективной питательной среды.
Ну что же, подведём промежуточные итоги:
- Мы синтезировали нужный нам ген;
- Вставили его в подходящий плазмидный вектор;
- Выбрали подходящий штамм-продуцент и произвели его трансформацию;
- Получили культуру клонов;
- Наконец, мы перенесли часть этих клонов в большой объём питательной среды с целью получить нужный нам белок в большом объёме.
Следующий шаг: выделить белок из полученной биомассы в настолько чистом виде, насколько это вообще возможно. Но это уже совсем другая история.
Видео:Клонирование ДНК - как и зачем это делаютСкачать

Молекулярные векторы, используемые в генетической инженерии
Вектор (англ. vector) – это «переносчик инфекции». Данное понятие применяется в разнообразных случаях. Примеры векторов из разных областей биологии:
1) кровососущие насекомые выступают как векторы патогенных микроорганизмов и вирусов, вызывающих болезни позвоночных животных;
2) насекомое из рода Sire.х – это вектор, переносящий пропагулы базидианального гриба Aniylostereum, вызывающего гниль ствола хвойных деревьев.
Молекулярный вектор – это молекула ДНК, в которую возможна встройка фрагмента чужеродной ДНК. Она способна переносить данный фрагмент в своем составе в реципиентные клетки, самостоятельно реплицироваться и стабильно поддерживаться в реципиентных клетках, либо встраиваться в геном хозяина и также стабильно в нем поддерживаться.
По другому определению, молекулярные векторы – это гибридные молекулы ДНК, несущие искусственно встроенный фрагмент, представляющий тот или иной интерес, и способные амплифицироваться (размножаться) в живых клетках отдельно от основного генома хозяина или встраиваться в него.
Видео:8 класс, 40 урок, Понятие вектораСкачать

Общие представления о нуклеиновых кислотах
ДНК – это биологический гетерополимер. В обычном состоянии первичная структура ДНК представляет собой двойную спираль, состоящую из двух длинных полимеров, закрученных вокруг обшей оси. Ширина спирали составляет 2-2,6 нм. Две цепи ДНК, образующие спираль, по своей химической структуре являются антипараллельными, т.е. ориентированы в противоположные стороны. В живой клетке спираль образует компактизированную структуру, в которой ДНК намотана на хроматиновые белки или гистоны. Остов ДНК образован сахарофосфатными группами, соединенными сложноэфирными связями. Сахарид, входящий в состав ДНК, является пентозой, т.е. 5-углеродным сахаром.
Единицы или мономеры ДНК – это нуклеотиды.
Основание, соединенное с сахаридом, образует нуклеозид, а нуклеозид, соединенный с остатком фосфорной кислоты в позиции пентозного кольца 5’, образует нуклеотид.
В результате репликации образуется две идентичные копии двойной спирализированной молекулы ДНК.
Конец молекулы, на котором имеется свободная гидроксильная группа, находящаяся в позиции 3’ пентозного кольца, называется три-штрих, или три-прим концом. Противоположный конец, на котором имеется остаток фосфорной кислоты, присоединенный к углеродному атому 5’ дезоксирибозы, называется пять-штрих, или пять-прим концом.
В рибонуклеиновой кислоте (РНК) в остов молекулы входит сахарид рибоза, у которого, в отличие от дезоксирибозы, в позиции 2’ пентозного кольца имеется гидроксильная группировка.
Основания в составе ДНК делятся на пурины и пиримидины. Пуриновые основания имеют 2 кольца, состоящие из атомов C и N, а пиримидины – одно кольцо. К пуринам принадлежат аденин и гуанин, к пиримидинам – цитозин и тимин, а также уроцил, который заменяет тимин в РНК.
Метилирование – это способ модификации нуклеотидов в живых системах. НДНК «схлопываются» подобно застежке-молнии. Матричные процессы и центральная догма молекулярной биологии Центральная догма молекулярной биологии описывает путь передачи генетической информации в клетке по генеральной схеме ДНК / матричная ГНК / белок. Матричная РНК (мРНК) называется еще мессенджер-PHК. Главныаиболее распространенный пример метилирования – это 5-метилцитозин. В двойной молекуле ДНК нуклеотиды образуют комплиментарные (взаимодополняющие) пары пурины-пиримидины, объединенные водородными связями. Между А и Т образуется 2 водородные связи, между G и С – 3. По этой причине пары G-С связаны более прочно.
В векторных системах ДНК используется как в одноцепочечной , так и двухцепочечной форме. Одна из цепей, кодирующая белок, называется смысловой, а комплиментарная ей – антисмысловой.
При температуре 90-95 градусов водородные связи между нитями ДНК рвутся, и двунитевая ДНК разделяется на две однонитевые молекулы. Этот процесс называется денатурацией, или плавлением. Если молекулы находятся в растворе, то при понижении температуры они ассоциируются вновь, благодаря комплиментарным взаимодействиям между нуклеотидами. Этот процесс называют гибридизацией. При этом нити ДНК «схлопываются» подобно застежке-молнии. Матричные процессы и центральная догма молекулярной биологии Центральная догма молекулярной биологии описывает путь передачи генетической информации в клетке по генеральной схеме ДНК / матричная ГНК / белок.
Матричная РНК (мРНК) называется еще мессенджер-PHК.
Главными путями передачи генетической информации являются:
— ДНК — ДНК (репликация ДНК);
— ДНК > мРНК (транскрипция у прокариот);
— ДНК — пре-мРНК — зрелая мРНК (транскрипция и созревание РНК );
— мРНК — белок (трансляция).
Специальные пути передачи информации:
— мРНК — ДНК (обратная транскрипция, для РНК-содержащих вирусов или ретровирусов);
— РНК — РНК (репликация РНК).
Репликация ДНК у про- и эукариот идет с помощью набора специальных ферментов. Главнейшие из них – ДНК-полимеразы, которые достраивают комплиментарную цепь на основе одноцепочечной молекулы, используя свободные мононуклеотиды в качестве строительных блоков.
Транскрипция происходит с участием фермента транскриптазы. Транскрипция и созревание мРНК у эукариот происходят в клеточном ядре, в частности на молекулярных машинах биосинтеза белка – рибосомах.
Экспрессия гена – это процесс, при котором заложенная в гене информация используется для синтеза функционального продукта. Функциональным продуктом может являться:
2) рибосомальная РНК;
3) тринспортная РНК;
4) малая ядерная РНК.
Последний из видов РНК принимает участие в сплайсинге и в процессе формирования рРНК. В случае применения векторов наибольший практический интерес представляет экспрессия белок-кодирующего гена.
Видео:Сергей Дмитриев. Генная инженерия.Скачать

Функции и главнейшие типы векторов
Предпосылки разработки и применения молекулярных векторов в генной инженерии и биотехнологии.
1. Открытие нуклеиновых кислот и генетического кода;
2. Открытие внехромосомных элементов у про- и эукариот – плазмид;
3. Открытие вирусов и в особенности механизмов встраивания вирусной ДНК в геном хозяина;
4. Разработка методов выделения высокоочищенных препаратов неповрежденных плазмид и неповрежденной ДНК вирусов;
5. Раскрытие механизмов проникновения чужеродной ДНК в клетки;
6. Открытие ферментов, обеспечивающих репликацию и модификацию ДНК.
Видео:Биотехнология и её направления. Клеточная и генная инженерия | Биология с Альбиной АмировойСкачать

Назначение векторов:
В фундаментальной науке векторы служат для изучения отдельных генов и целых геномов путем их клонирования и последующего сиквенса, для изучения функций генов и молекулярных механизмов их экспрессии. В инженерии векторы используются с целью создания генно-модифицированных организмов продуцентов.
Видео:Лаборатория генной инженерии в домашних условиях: Александр Савсуненко at TEDxDonetskСкачать

Главнейшие типы векторов (по назначению):
- Клонирующие векторы – служат для наработки большого количества копий встроенного фрагмента ДНК (например, с целью его последующего сиквенса – расшифровки последовательности);
- Экспрессирующие векторы – служат для получения чужеродного белка в организме-хозяине (организме-продуценте); векторы, обеспечивающие правильную и эффективную экспрессию чужеродных генов в клетках. Встроенный в вектор ген не только амплифицируется, но на его основе происходит образование мРНК и затем белков. Экспрессирующие векторы используются для создания штаммов микроорганизмов, продуцирующих чужеродный белок в повышенных количествах.
- Нацеленные векторы – служат для введения дефектного гена в геном изучаемого oрганизмa с целью выявления фенотипического проявления генов. Вектор, используемый для инактивации какого-либо гена при генетических исследованиях определенных организмов, называют нацеленным.
По поведению относительно генома хозяина векторы делят на интегративные и неинтегративные. Если вектор обеспечивает встройку чужеродной ДНК в геном клетки, то он называется интегративным.
Видео:Генная инженерия. Как редактируют ДНК, и возможно ли создавать генно-модифицированных людей?Скачать

Молекулярный вектор должен обладать:
1) участком, определяющим начало репликации;
2) сайтом для встройки чужеродной ДНК;
3) селективным маркером.
Необходимые свойства клонирующих векторов:
1) вектор должен нести нуклеотидную последовательность, которая отвечает за автономную репликацию данной молекулы в определенном типе клеток;
2) не должен терять репликативных свойств даже при встройке чужеродного фрагмента ДНК;
3) должен иметь как можно малое число мест расщепления определенной рестриктазой, лучше один сайт или локус рестрикции;
4) должен содержать 1 или несколько генетических маркеров, по которому может быть произведен отбор клоном, т.е. если вектор успешно внедрился в клетку, эту клетку необходимо отобрать по хорошо различимому признаку и размножить, а затем произвести молекулярное клонирование;
5) должен реплицироваться с образованием повышенного числа копий в клетке.
Молекулярное клонирование, или как засунуть в клетку чужеродный генетический материал
30 октября 2011
Молекулярное клонирование, или как засунуть в клетку чужеродный генетический материал
- 28103
- 14,4
- 13
- 23
Клонирование овечек имеет лишь самое опосредованное отношение к молекулярному клонированию. На фоне овечки Долли показана плазмида phMYT1L-N106.
коллаж автора статьи
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Огромное количество биологических исследований начинается с того, что в клетку вносится чужеродный генетический материал. Это действие называется молекулярным клонированием. С его помощью можно получить генетически модифицированные организмы, включить и выключить отдельные гены или определить роль конкретного белка в каком-нибудь процессе. Можно сказать, что молекулярное клонирование — это краеугольный камень, основа основ, фундамент, без которого множество замечательных методик было бы неосуществимо. Однако засунуть в клетку «неродную» ДНК не так-то просто: это длинный, трудоемкий и многоэтапный процесс. Молекулярному клонированию посвящены толстые книги, но, тем не менее, я попробую хотя бы немного рассказать о том, что это такое, и что нужно для того, чтобы все получилось.
«Био/мол/текст»-2011
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2011 в номинации «Лучшая обзорная статья».
Вставка
Раз мы собираемся вставлять в клетки какой-то ген, то самый первый, очевидный шаг, который нам нужно сделать, — этот ген как-нибудь получить, причем желательно в больших количествах (поскольку все методики несовершенны, бóльшая часть копий этого гена бесследно пропадет по дороге нецелевым способом). Чужеродный ген, вносимый в клетку, называется «геном-вставкой» или просто «вставкой». Получить его можно несколькими способами.
Во-первых, мы можем просто выделить его из того генома, к которому он принадлежит. Допустим для простоты, что наша вставка — это какой-нибудь ген слона. Тогда нам нужно:
- получить образец тканей слона;
- извлечь из этого образца ДНК;
- вычленить из этой ДНК интересующий нас ген и получить его в больших количествах (для этого используется ПЦР ). [Заметим в скобках, что получение гена с помощью ПЦР возможно, только если мы знаем его нуклеотидную последовательность или хотя бы последовательность его начала и окончания (для того, чтобы можно было синтезировать праймеры). Если же все это нам неизвестно, то придется сначала анализировать слоновий геном.]
Подробнее с методом ПЦР и другими основными молекулярно-биологическими методиками можно ознакомиться в статье «Важнейшие методы молекулярной биологии и генной инженерии»; с геномными исследованиями — в статье «Геном человека: как это было и как это будет». — Ред.
Во-вторых, вполне возможно, что нужный нам ген уже был выделен из генома слона и присутствует в библиотеке генов. Тогда нашу вставку можно будет получить оттуда (с этим, на самом деле, тоже придется повозиться, но меньше, чем в первом случае).
И наконец, в-третьих, не обязательно использовать в качестве вставки уже существующий ген. Если исследователь собирается работать с каким-нибудь геном, который является плодом его фантазии и не встречается в природе, то он может синтезировать его искусственно.
Вектор
Запускание в клетку «одинокой» вставки (то есть, гена самого по себе, безо всякого сопровождения) — дело совершенно бесперспективное. В клетке плавает множество расщепляющих ДНК ферментов (нуклеаз), которые с радостью набросятся на беззащитную вставку и разрежут ее на кусочки, в результате чего она бесславно исчезнет, не успев совершить ничего полезного, а клонирование провалится.
Поэтому, чтобы защитить вставку, ее встраивают в специальное «транспортное средство», которое называется вектором. В самом элементарном случае вектор — это просто последовательность ДНК, в которую вшивается наша вставка, и которая помогает ей не пропасть в клетке и выполнить свое предназначение. Существует несколько видов векторов, но среди исследователей самой большой (и заслуженной) любовью пользуется один из них — плазмиды. С них-то мы и начнем.
Плазмида
Плазмида — это довольно короткая и обычно кольцевая молекула ДНК, которая плавает в цитоплазме бактериальной клетки (зеленые кружочки на рис. 1). Плазмиды не связаны с бактериальной хромосомой, они могут реплицироваться независимо от нее, могут «выплевываться» бактерией в окружающую среду или, наоборот, из этой окружающей среды «проглатываться». С помощью плазмид бактерии обмениваются друг с другом генетической информацией, — например, передают соседям устойчивость к какому-нибудь антибиотику.
Рисунок 1. В бактериальной клетке наряду с бактериальной хромосомой плавает еще и множество плазмид.
рисунок автора статьи
Плазмиды существуют внутри бактерий в естественных условиях, поэтому никто не может помешать исследователю искусственно синтезировать плазмиду, которая будет обладать нужными для него свойствами, вшить в нее вставку (или несколько) и запустить в клетку. Плазмида — это, можно сказать, «болванка» для молекулярного биолога. Поэтому плазмиды стараются сделать как можно более универсальными и подходящими для всех случаев жизни.
Для того, чтобы из плазмиды получился рабочий вектор, она должна обладать некоторыми важными характеристиками.
Размножение
Прежде всего, плазмида обязательно должна в клетке размножаться, реплицироваться, потому что иначе она быстро подвергнется деградации, а вместе с ней исчезнет и ген-вставка. Для этого в ней должна быть специальная последовательность под названием «точка начала репликации», с которой и начинается удвоение ДНК. У разных видов живых существ эти точки имеют разную нуклеотидную последовательность. Поэтому, если мы хотим создать плазмиду, которая бы реплицировалась сразу в двух видах клеток (например, и в дрожжевых, и в бактериальных), то нам надо вставить в нее две точки начала репликации.
Разрезание
Кроме того, в ДНК плазмиды должны быть участки, в которых ее можно будет разрезать, чтобы вшить туда вставку. В качестве «ножниц» используются особые ферменты — рестриктазы. Они прекрасны тем, что режут ДНК не где попало, а в строго определенных местах, которые называются сайтами рестрикции (каждая рестриктаза распознает только свой сайт и только в нем (или возле него) разрезает ДНК). Обычно в плазмиду ставят множество разных сайтов рестрикции, расположенных в разных точках, — благодаря этому ее можно будет разрезать в нужном месте нужной рестриктазой. Участок ДНК, на котором собрано несколько сайтов рестрикции, называется полилинкером.
Селекция
Процесс, при котором бактерия «глотает» плазмиду, именуется трансформацией. В естественных условиях трансформироваться может в каждый момент времени не вся популяция бактерий, а только ее часть — компетентные клетки. Существуют лабораторные методы, с помощью которых можно искусственно увеличить количество компетентных клеток (некоторые из них описаны ниже в главе «Как засунуть вектор в клетки»), однако, все равно, стопроцентная компетентность для бактериальной культуры — вещь недостижимая.
Так что, добавляя плазмиду к бактериям, мы заранее должны смириться с тем, что бóльшая часть бактериальных клеток так и останется бесплазмидной, нетрансформированной. Поэтому нам придется отделять зерна от плевел, — то есть, трансформированные клетки от всех остальных. Для этого используется простой, но остроумный прием.
Допустим, мы встроили в нашу плазмиду ген устойчивости к какому-нибудь антибиотику (такой ген называется селективным маркером). Теперь клетки, которые «съели» плазмиду, будут неуязвимы для этого антибиотика и смогут спокойно жить в его присутствии. В результате, чтобы выделить из всех бактерий, к которым мы добавили плазмиду, те, которые смогли эту плазмиду использовать по назначению, нам достаточно будет добавить к бактериальной культуре соответствующий антибиотик. Те клетки, которые нам нужны, смогут существовать и делиться в присутствии этого антибиотика, а остальные этого делать не смогут.
Существуют и другие способы провести селекцию. Можно, например, поместить сайт рестрикции не внутрь гена антибиотика, а внутрь какого-нибудь «заметного» гена (скажем, такого, в присутствии которого бактериальные культуры меняют цвет). В результате можно будет отличить нужные колонии от ненужных просто на глаз, безо всяких манипуляций. По такому принципу работает, например, очень модная сейчас система бело-голубой селекции.
Если мы собираемся работать только на бактериях, то всем вышесказанным дело и ограничится. Однако если конечная наша цель — засунуть вектор в эукариотические клетки (например, клетки млекопитающих), то нам предстоит еще один этап селекции.
Дело в том, что в большинстве эукариотических клеток плазмиды живут недолго и быстро подвергаются деградации. Поэтому, даже если мы заставили клетку «съесть» плазмиду, не стоит питать надежды, что наша вставка теперь останется в этой клетке навсегда. Скорее всего, она успеет только немного поэкспрессироваться, прежде чем содержащий ее вектор будет пойман нуклеазой и разрезан на кусочки. Однако если вектор случайно смог встроиться в геном (это событие очень редкое, но не невероятное), то наша вставка, можно сказать, пустит в этой клетке корни — причем не только в ней самой, но и во всех ее потомках. И для того, чтобы выделить из всех клеток те, которые имеют вектор в своем геноме, нам понадобится еще один селективный маркер — ген устойчивости к какому-нибудь эукариотическому антибиотику (потому что бактериальные антибиотики, как правило, на клетки эукариот не действуют). Добавив соответствующий антибиотик (например, генетицин) к среде, в которой культивируются клетки, мы через некоторое время получим популяцию только тех клеток, в геноме которых сидит наш вектор.
Промоторы
Перед каждым рабочим геном находится короткий участок ДНК под названием промотор. Именно сюда прикрепляется фермент РНК-полимераза, который синтезирует РНК на матрице ДНК, что является первым и абсолютно необходимым этапом в экспрессии гена. Если у гена нет промотора, его экспрессию запустить невозможно, и он так и останется «молчащим». Можно сказать, что ген без промотора — это все равно, что машина без педали газа. Поэтому в нашей плазмиде обязательно должен быть хотя бы один промоторный участок, под контроль которого можно будет поставить ген-вставку.
А промоторы бывают разные.
Во-первых, они различаются по своей силе. Некоторые вызывают бурную транскрипцию подконтрольного гена, другие — совсем вялую.
Во-вторых, у прокариот и эукариот промоторы отличаются. Прокариотические промоторы не работают в эукариотических клетках и наоборот. Поэтому будет Ужасной Ошибкой поставить тот ген, который должен, экспрессироваться в бактериальных клетках, под эукариотический промотор — это все равно, что оставить его без промотора вообще.
В-третьих, у эукариот есть несколько типов РНК-полимеразы — они обеспечивают синтез различных видов РНК. И каждый тип РНК-полимеразы распознает только свои промоторы и «не видит» чужие. Поэтому, в зависимости от того, какую именно РНК кодирует наша вставка (например, матричную или, наоборот, шпилечную, а может, и вовсе рибосомальную), нам нужно подбирать и тип промотора, который мы будем ставить в плазмиду.
И, наконец, в-четвертых, разные промоторы включаются по-разному. Некоторые активны постоянно. Другие активизируются только при определенных условиях — например, при повышении окружающей температуры или появлении в клетке каких-то веществ. К тому же, у многоклеточных организмов в каждой ткани включены одни промоторы и выключены другие. Можно, например, подобрать такой промотор, который будет активен только в нейронах. Или только в нейронах головного мозга. Или только в нейронах головного мозга, относящихся к одному из подкорковых ядер. Или только в крохотной субпопуляции нейронов головного мозга, относящейся к одному из подкорковых ядер. И сужать этот круг можно почти до бесконечности.
Знание всего этого дает исследователю удивительную свободу. Подобрав в плазмиду подходящий промотор, он сможет творить с экспрессией гена-вставки почти все, что ему заблагорассудится. Ну, скажем, сделать так, чтобы он экспрессировался сильно, только в мышечных клетках и только в ответ на повышение температуры.
Трансляция белка
Засовывая вектор в клетку, ученый может хотеть двух разных вещей:
- чтобы происходила только транскрипция гена-вставки (то есть, синтез РНК на матрице ДНК — например, этого достаточно, если в клетку вносится какая-нибудь некодирующая РНК);
- чтобы происходила и транскрипция, и трансляция гена-вставки (то есть, экспрессия кодируемого вставкой белка).
В первом случае вектор называется транскрипционным, во втором — экспрессионным. Экспрессионные векторы обычно немного сложнее транскрипционных, потому что в них присутствуют:
- Консенсусная последовательность Козак. Это длинное имя носит короткий (примерно в 10 нуклеотидов) фрагмент в самом начале молекулы матричной РНК, который через белки-посредники обеспечивает связывание этой мРНК с рибосомой (без чего, как нетрудно догадаться, синтез белка невозможен). Последовательность Козак характерна только для эукариот, причем у представителей разных видов она немного отличается. Поэтому, создавая экспрессионный вектор, надо вставлять в него последовательность, которая характерна именно для того живого существа, в клетки которого мы собираемся вставлять вектор. Кроме того, последовательность Козак бывает сильной и слабой — то есть, приводящей к синтезу большого или малого количества белка. У прокариот роль последовательности Козак выполняет последовательность Шайна-Дальгарно, которая непосредственно (в смысле — без посредников, в отличие от последовательности Козак) соединяется с рибосомой, после чего и начинается синтез белка;
- Последовательность Козак находится перед вставляемым геном. А после него должны находиться еще несколько коротких участков, к которым присоединяются белки, выполняющие полиаденилирование — пришивание к концу свежесинтезированной РНК полиаденинового хвоста. Этот хвост выполняет несколько функций, в том числе, обеспечивает экспорт РНК в цитоплазму и помогает организации трансляции — то есть, если мы хотим обеспечить синтез белка на основе нашей РНК, нам без него не обойтись;
- мРНК, которая служит матрицей для синтеза белка, может быть транскрибирована только и исключительно РНК-полимеразой II типа. Поэтому нам нужно вставить в плазмиду именно тот промотор, который работает с этой РНК-полимеразой.
Итак, мы подобрали все необходимые для плазмиды кусочки. Но мало просто соединить их вместе — огромную роль играет их взаимное расположение. Например, сайты рестрикции должны быть не только многочисленны и разнообразны, но и находиться в «правильных» местах. При этом надо стараться, чтобы итоговая плазмида была как можно компактней, поскольку, во-первых, так она будет стабильнее, а во-вторых, охотнее «проглотится» клеткой. Одним словом, вы уже, наверное, поняли, что дизайн хорошей плазмиды — это тонкое и филигранное искусство (рис. 2).
Рисунок 2. Структура знаменитой плазмиды PBR322. В свое время это была, пожалуй, самая популярная плазмида во всем научном мире, а потом она стала основой для множества плазмид нового поколения. В ней есть участок начала репликации (ori), благодаря которому она может размножаться в клетках бактерии E. coli, гены устойчивости к двум антибиотикам — ампициллину (amp) и тетрациклину (tet), а также множество сайтов рестрикции (на самом деле их больше сорока, но здесь представлены только четыре — EcoRI, SalI, PstI, BamHI). Промоторные участки, к сожалению, не показаны, но они, разумеется, тут тоже есть. Некоторые сайты рестрикции находятся в генах устойчивости к ампициллину или тетрациклину, в результате чего и тот и другой сайт можно использовать в качестве второго селективного маркера. Например, если мы разрежем ген устойчивости к ампициллину с помощью рестриктазы PstI и вошьем в это место вставку, то тетрациклин будет первым селективным маркером, ампициллин — вторым, а селекция будет выглядеть так:
- Трансформируем бактерии, выращиваем их на среде с тетрациклином и выбираем только хорошо растущие клоны.
- Переносим эти клоны на среду с ампициллином и выбираем те, рост которых угнетается.
Если же мы вошьем вставку внутрь гена устойчивости к тетрациклину (разрезав его с помощью рестриктаз BamHI или SalI), то нам надо будет, наоборот, сначала посадить их на среду с ампициллином, а потом — с тетрациклином.
Плазмидные базы данных
За те несколько десятилетий, что существует методика молекулярного клонирования, были синтезированы тысячи разнообразных плазмид, из которых созданы базы данных (например, AddGene). В этих базах есть плазмиды на все случаи жизни — с разными типами точек начала репликации, разными полилинкерами, разными селективными маркерами и промоторами и так далее. Есть те, в которые можно вшить не одну вставку, а несколько, а есть даже такие, которые уже несут в себе некоторые особенно популярные вставки. Поэтому, как правило, исследователи не синтезируют плазмиду для клонирования самостоятельно, а покупают уже готовую. При необходимости купленную плазмиду можно «довести до ума», вставив или убрав определенные участки (а потом эту модифицированную плазмиду тоже добавить в базу данных). Иными словами, часто задача ученого сводится просто к тому, чтобы подобрать подходящую плазмиду.
Другие векторы
Плазмида — прекрасный вектор для относительно небольших вставок. Если ген-вставка слишком велик, то плазмида утрачивает стабильность, потому что ее участки начинают «перетасовываться» друг с другом и теряться при репликации, из-за чего она постепенно укорачивается. Поэтому в качестве вектора для длинных вставок используются более устойчивые конструкции. Например:
- Космида — гибрид плазмиды и фага (вируса, который заражает бактерии). По сути дела, это просто плазмида, в которую добавлены сайты для связывания с белками оболочки фага (они называются cos-сайтами, и именно благодаря им космиды получили свое название). Белковая оболочка делает космиду стабильнее, благодаря чему в нее можно загружать более длинные вставки;
- Искусственные хромосомы (человеческие, бактериальные, дрожжевые) — это сложные и крупные конструкции, являющиеся по сути микрохромосомами. Они относительно стабильны и при этом обладают гигантской емкостью: в них можно вставлять сразу несколько генов. Однако из-за огромных размеров их гораздо труднее засунуть в клетку;
- И, наконец, есть еще один вид векторов — вирусные. Этот вид настолько важен, что ниже ему будет посвящен целый раздел.
Вставляем ген в плазмиду
Допустим, исследователь подобрал подходящую плазмиду и получил нужную вставку. Теперь нужно соединить одно с другим, чтобы затем засунуть в клетки. Для этого достаточно совершить несколько простых действий.
Как уже говорилось, в плазмиде существует несколько сайтов рестрикции — то есть, участков, в которых ее может разрезать нужная рестриктаза. Нам нужно выбрать подходящий сайт, который будет находиться в том месте, куда мы собираемся вшивать вставку, а затем обработать плазмиду соответствующей рестриктазой.
После этого той же рестриктазой нужно обработать вставку, поскольку рестриктазы обычно оставляют выступающие концы на одной из нитей ДНК, и эти концы должны быть совместимы у вставки и плазмиды, чтобы они согласились соединиться. Если на кончиках вставки нет нужных сайтов рестрикции, то можно приделать к нему короткие ДНК-фрагменты с нужными сайтами рестрикции на концах.
И наконец, нам нужно соединить в одной пробирке плазмиду и вставку (предварительно очищенные от рестриктаз) и добавить к ним ДНК-лигазу, которая умеет лигировать (то есть, сшивать воедино) две молекулы ДНК. Конечно, в результате мы получим не только желанный вектор, в котором плазмида соединена со вставкой (назовем его чеширским котом с улыбкой), но и целый коктейль побочных продуктов — пустую плазмиду (кота без улыбки), замкнутую вставку (улыбку без кота), несколько сшитых между собой вставок (много улыбок) и так далее. В ходе селекции эти ненужные продукты отсеются, и у нас в руках останется только вектор.
Выделяем вектор
Итак, вначале мы проводим селекцию.
- Увеличиваем компетентность бактерий, добавляем к ним «коктейль», полученный в результате лигирования, а потом высеваем эти бактерии на среду с антибиотиком, который является нашим первым селективным маркером;
- Выбираем те бактериальные клоны, которые растут на среде с антибиотиком — они смогли съесть плазмиду со вставкой или хотя бы просто плазмиду (кота — с улыбкой или без);
- Проводим с этими клонами второй этап селекции, в зависимости от того, какой ген мы использовали в качестве второго селективного маркера. Например, если этот ген — устойчивость к другому антибиотику, то мы переносим бактерии на среду с этим антибиотиком и выбираем те клоны, рост которых угнетается, — они ухитрились проглотить не просто плазмиду, а плазмиду, в которую была вшита вставка (кота с улыбкой);
- Выращиваем полученную культуру бактерий.
И вот мы получили ее — бактериальную культуру, в которой живет созданный нами вектор. Вполне возможно, что это и было нашей конечной целью, и теперь мы, спокойные и счастливые, можем, например, включить в бактериях экспрессию гена-вставки и пожинать урожай синтезированных в результате белков.
Но если нам нужен чистый вектор, который можно будет потом засовывать в другие клетки, то у нас появляется проблема, которая кажется неразрешимой. Как вызволить вектор из бактерий? Ведь даже если мы выделим из этих бактерий ДНК, то помимо вектора получим еще и совершенно ненужную нам бактериальную хромосому.
Тут можно воспользоваться тем, что плазмидная ДНК имеет важные отличия от хромосомной: она, во-первых, гораздо меньше по размеру, а во-вторых, гораздо больше суперскручена. Поэтому можно подобрать такие условия, в которых бактериальные хромосомы будут осаждаться, в то время как плазмиды останутся плавать в растворе. Достаточно будет отцентрифугировать получившийся осадок (чтобы вся бактериальная ДНК прочно «упала на дно»), а затем уже из надосадочной жидкости выделить нашу плазмиду (обычно для этого используются специальные колонки, которые очень облегчают и ускоряют работу).
Как засунуть вектор в клетки
И вот наступил желанный миг. Исследователь держит в руке пробирку, в которой плещется прозрачная жидкость — столькими трудами полученный вектор. И тут перед ним встает преграда. Клетки, в которые он собирается засунуть свой вектор, отказываются его глотать.
Дело в том, что липидная мембрана, которой окружены клетки, обладает избирательной проницаемостью — то есть, она пропускает через себя одни частицы и не пропускает другие. Крупные заряженные молекулы (а именно таковой и является ДНК) через эту мембрану самопроизвольно пройти не могут. И если бактерии, например, умеют проглатывать плазмиды из внешней среды (как уже было сказано выше), то, скажем, клетки животных к этому совершенно не склонны. Поэтому для того, чтобы засунуть в клетку вектор, исследователю приходится прибегать ко множеству хитростей, о которых и будет сейчас рассказано. Но сначала — немного терминов.
Для внесения в клетку вектора есть несколько обозначений в зависимости от того, какой используется вектор и в какие клетки он вносится.
- Трансформация (о которой уже было немного рассказано) — это внесение плазмид (и других невирусных векторов) в бактерии, а также клетки растений и грибов;
- Трансфекция — то же самое, что и трансформация, но только в применении к клеткам животных;
- И, наконец, трансдукция — это внесение в любые клетки вирусного вектора.
Эти термины, в общем, не очень строгие. Например, даже в некоторых солидных статьях трансдукцию иногда называют вирусной трансфекцией (а то и просто трансфекцией).
Вещества-проводники
Самый простой и очевидный путь внесения в клетку генетического материала — соединить вектор с каким-нибудь переносчиком, у которого нет проблем с проникновением через мембрану, и позволить получившемуся комплексу пролезть внутрь клетки. Это не отнимает много времени и не требует дорогостоящего оборудования. Такой способ обычно называют химической трансфекцией. В этом случае события развиваются по следующему сценарию:
- Вектор соединяется с переносчиком;
- Получившийся комплекс проглатывается клеткой и оказывается в цитоплазме;
- В цитоплазме комплекс разваливается и вектор высвобождается;
- Вектор проникает в ядро и выполняет свое предназначение (скажем, с него начинает транскрибироваться мРНК).
К сожалению, почти на каждом из этих этапов возникают трудности. Во-первых, клетки захватывают далеко не все плавающие вокруг них комплексы. Во-вторых, не факт, что, оказавшись внутри клетки, вектор отделится от переносчика — вполне возможно, что они так и будут в обнимку плавать в цитоплазме, пока не подвергнутся деградации. В-третьих, даже если какой-то редкий комплекс умудрился проникнуть в клетку и там развалиться, это означает, что помимо вектора в клетке оказывается еще и переносчик, который может быть токсичен, вызывать побочные эффекты и вообще «замыливать» результаты экспериментов. И, наконец, в-четвертых, только небольшая часть вектора, оказавшегося внутри клетки, сможет проникнуть в ядро. Иными словами, комплексы вектора с переносчиком надо добавлять к клеткам в огромном избытке, чтобы хотя бы маленькая часть из них выполнила свое предназначение.
Утешает то, что среди производителей веществ-переносчиков огромная конкуренция, и поэтому на рынке постоянно появляются новые составы с улучшенными свойствами, которые минимизируют вышеописанные трудности. У каждого из составов есть какая-то своя «фишка», которая дает ему преимущество в конкурентной борьбе — некоторые образуют с вектором такие компактные комплексы, которым гораздо легче пробраться внутрь клетки; другие эффективнее отделяются от вектора, оказавшись в цитоплазме; третьи более универсальны и работают на огромном количестве типов клеток; четвертые, наоборот, славятся своей избирательностью и проникают только в те клетки, которые, например, экспрессируют какой-то специфический рецептор. Одним словом, если исследователь решил засунуть вектор внутрь клетки с помощью химической трансфекции, то ему просто надо выбрать из множества составов, представленных на рынке, тот, который будет лучше работать в данном конкретном случае.
Дырки в мембране
Но некоторые клетки так привередливы и капризны, что в принципе не соглашаются глотать комплексы ДНК с переносчиком (таким скверным характером славятся, например, первичные клетки — то есть, те, которые не выращивались в культуре, а были получены непосредственно от живого организма). Чтобы ввести в эти клетки генетический материал, ученому приходится прибегать к грубой силе — продырявливать мембрану и засовывать ДНК в образовавшиеся отверстия. Этот жестокий подход называется физической трансфекцией; он очень травматичен для клеток, и только некоторые из них переживут столь неделикатное обращение. Поэтому применять данную методику стоит, только если вы точно уверены, что обладаете достаточным количеством клеток и можете пожертвовать бóльшей частью из них. Ну и к тому же, вам потребуется довольно дорогое оборудование.
Наверное, самый распространенный способ продырявливания мембраны называется электропорацией. Дело в том, что у клеток, попавших в электрическое поле, в мембране возникают отверстия (которые получаются тем больше, чем сильнее приложенное к клеткам поле). Если эти отверстия малы, то клетка сможет «залечить» их; если же они слишком велики, то клетка погибнет из-за необратимого нарушения целостности мембраны. Поэтому эмпирическим путем можно подобрать оптимальную величину поля для того, чтобы клетки, с одной стороны, продырявились, а с другой — остались в живых. А когда клетки продырявлены, то добавленный к ним вектор проникает сквозь отверстия и оказывается в цитоплазме.
Кроме электропорации, есть еще несколько способов — экзотических и не очень — сделать в мембране дырки. Например, с помощью:
- Ультразвука (это называется сонопорация);
- Лазера (оптическая трансфекция);
- Нанопроволоки с пришитым к ней вектором, которая физически прокалывает мембрану (импалефекция);
- Магнитных взаимодействий (магнитофекция или магнитная трансфекция). В этом случае вектор присоединяется к магнитным наночастицам, которые транспортируются внутрь клетки с помощью магнитного поля.
Ну и наконец, для самых непокорных клеток, которые не поддаются никакой из вышеописанных методик, существует прибор под названием «генная пушка». Генная пушка расстреливает упрямые клетки частичками металла (обычно используется золото) с присоединенным к ним вектором. (Источником вдохновения для изобретателей этого прибора послужил пневматический молоток.) Генная пушка подходит практически для всех типов клеток, включая растительные, окруженные твердой клеточной стенкой, которая является практически непреодолимой преградой для большинства других методик.
А вообще, почти все вышеописанные методики дают более-менее похожие результаты на большей части типов клеток, а приборы для них стоят дорого. Поэтому, как правило, лаборатория покупает прибор для какой-то одной методики, и дальше уже по этой методике и доставляет генетический материал в клетки.
Овечки в волчьей шкуре
Зачем придумывать новые и трудные пути засовывания в клетку нуклеиновых кислот, если можно воспользоваться теми элегантными способами, которые за время долгой эволюции изобрели существа (или, возможно, вещества; нельзя точно сказать, живые они или нет), для которых транспортировка своего генетического материала внутрь клетки является необходимой фазой жизненного цикла? Все, наверное, уже догадались, что речь идет о вирусах.
Вирусы — это молекулы ДНК или РНК, упакованные в белковую оболочку (а иногда завернутые в липидный слой со встроенными в него вирусными белками). Именно оболочка играет главную роль в проникновении вируса через клеточную мембрану. Поэтому если засунуть в эту оболочку невирусную нуклеиновую кислоту, то она, будто вирус, тоже сможет попасть в клетку — как овечка, одетая в волчью шкуру. На этом принципе и основано использование вирусных векторов. Пожалуй, вирус — это самое эффективное транспортное средство для доставки в клетку генетического материала. Но приготовление вирусных векторов очень хлопотно, долго и трудоемко. Да вы сейчас и сами увидите.
Итак, чтобы сделать вирусный вектор, нужно для начала подобрать подходящий вирус. Идеальный кандидат:
- Стабилен — то есть, не склонен к спонтанным геномным перестройкам;
- Ёмок — то есть, может вместить в себя даже самую большую вставку;
- Не влияет на жизнедеятельность клетки;
- Не вызывает иммунного ответа;
- Встраивает свой геном не в первое попавшееся место генома хозяина (это может привести к непредсказуемым последствиям и вообще «замылить» результаты экспериментов), а в какую-нибудь определенную точку (а еще лучше — в точку, заданную самим исследователем);
- И обладает другими симпатичными чертами.
К сожалению, идеал недостижим, и ученым приходится выбирать из того, что есть. А именно:
Ретро
Ретровирусы долгое время были самой популярной основой для векторов. Это РНК-содержащие вирусы, которые, оказавшись в клетке, синтезируют ДНК на основе своей РНК с помощью ревертазы (собственно, поэтому они и называются «ретро», ведь синтез ДНК на основе РНК — это, в каком-то смысле, шаг назад). Ретровекторы хорошо выполняют свое предназначение, то есть, стабильно доставляют в клетку заключенный в них генетический материал, но у них есть несколько недостатков, из-за которых работать с ними неудобно.
Во-первых, они все (за одним исключением, о котором скоро будет рассказано) способны инфицировать только делящиеся клетки. Поэтому если исследователь, например, собрался изучать нейроны, которые не склонны к делению, ему надо забыть о ретровекторах и начать искать что-нибудь другое.
Во-вторых, ретровирусы встраиваются в самые непредсказуемые участки генома, каждый раз разные, и это приводит к самым непредсказуемым последствиям. Для начала, из-за этого нарушается воспроизводимость экспериментов — но это еще ладно. Беда в том, что ретровектор может вклиниться в середину какого-нибудь важного гена, из-за чего этот ген выключится, а в клетке начнутся патологические изменения, которые могут довести ее до гибели. Или, наоборот, ретровектор может случайно включить какой-нибудь совершенно ненужный ген, например, онкоген, что также приведет к очень печальным результатам (особенно если исследования проводятся не на культуре клеток, а на живом организме, и особенно если этот организм — человеческий).
Эти недостатки отвратили сердца ученых от ретровекторов и заставили их искать что-нибудь более подходящее. И найти кое-что замечательное удалось прямо внутри ретровирусного семейства.
Ленти
Лентивирусы — это род ретровирусов, который отличается от прочих представителей своего семейства некоторыми приятными с точки зрения молекулярного клонирования чертами.
Прежде всего, лентивирусы умеют заражать не только делящиеся, но и неделящиеся клетки. Эта особенность ужасна с точки зрения врача, который лечит вызванное лентивирусом заболевание, и прекрасна с точки зрения молекулярного биолога, который делает на основе лентивируса лентивектор. Ведь работая с таким вектором, ученый сможет использовать гораздо более широкий ассортимент клеточных типов, а значит, сделать гораздо больше великих открытий.
Плюс к тому, лентивекторы довольно емкие, то есть, они способны вместить в себя крупные вставки. Отчасти это связано с тем, что из их генома в целях безопасности выкидывается бóльшая часть, и в результате освобождается куча места. Ну и кроме того, лентивирусы встраиваются в чуть менее непредсказуемые участки генома, чем прочие ретровирусы, а это тоже очень здорово.
«Ленти» по латыни значит «медленный». Это слово очень точно отражает характер лентивирусов — они вызывают заболевания с необычайно длинным инкубационным периодом. Вирус СПИДа — это тоже, кстати, лентивирус.
Адено
Аденовирусы, наряду с ретровирусами, долго были самой популярной основой для векторов, но теперь потихоньку сдают свои позиции. Аденовирусы способны заражать не только делящиеся, но и неделящиеся клетки; ассортимент клеточных типов, которые они заражают, довольно широк. Но они не встраиваются в хозяйский геном, и поэтому подходят не для всех экспериментов. Кроме того, аденовирусы часто вызывают сильный иммунный ответ. Поэтому все чаще они используются не в базовых исследованиях, а для всяких прикладных целей — например, для создания вакцин.
И наконец, относительно недавно на сцене появился новый персонаж, который сразу расположил к себе ученых множеством чудесных качеств. Зовут его аденоассоциированный вирус (AAV).
AAV ведет себя настолько тихо, скромно и ненавязчиво, насколько этого вообще можно ждать от вируса. Практически единственное, что он делает, оказавшись в клетке, — это встраивается в хозяйский геном, причем почти всегда не в первое попавшееся, а в строго определенное место. Он, судя по имеющимся сейчас данным, не вызывает никаких заболеваний, поэтому и иммунный ответ на него очень слабый. К тому же, он способен заражать и делящиеся, и неделящиеся клетки. Одним словом, AAV — просто идеальная основа для вектора, хотя и он не лишен некоторых недостатков. И главный его недостаток — малая емкость. В AAV-вектор могут влезть только совсем небольшие вставки, и в этом он очень проигрывает, например, лентивекторам.
Кроме того, AAV — дефективный, несамостоятельный вирус. Он может размножаться только в клетках, которые уже заражены аденовирусом (что и отражено в его названии). Это совсем неплохая черта, если мы хотим заразить нашим вектором культуру клеток; но если мы собираемся делать вектор для генной терапии (методики лечения генетических (и не только) заболеваний, при которой организм заражается вирусным вектором, несущим необходимые этому организму гены), то такая дефективность будет нам очень мешать, потому что вирусы не смогут как следует распространяться по организму. Однако сейчас эта проблема решена, и разработаны AAV-векторы, которые способны размножаться сами по себе, безо всякой помощи.
Но вот подходящий вирус подобран. Теперь начинаются игры с его геномом.
- Вначале нам нужно освободить в этом геноме место — то есть, выкинуть из него какие-то гены. Обязательно нужно оставить те участки, на которые налипает оболочка (чтобы наш вектор был полноценным, «одетым» вирусом), и те гены, которые обеспечивают встраивание вирусного генома в геном хозяйской клетки (чтобы он мог выполнить свое предназначение); при этом от других областей — например, генов белков оболочки — мы можем с чистой совестью избавиться;
- Из получившегося «огрызка» генома делается плазмида — вставляются фрагменты, о которых уже было рассказано выше (точки начала репликации, селективные маркеры и так далее). В принципе, такие плазмиды уже есть в плазмидных базах данных, и, как правило, задача исследователя сводится к тому, чтобы подобрать подходящую;
- В эту плазмиду вшивается необходимая вставка (со всеми прелестями многоэтапной селекции, которые были описаны выше).
Теперь у нас возникает небольшая проблема. Даже засунув эту плазмиду в клетку, никаких вирусов мы не получим, потому что мы уже выкинули (в пункте 1) те гены, которые нужны для их создания. Поэтому нам придется пойти на маленькую хитрость.
Мы засунем в клетки не одну плазмиду, а две. Первая, основная (назовем ее Пу), — это та, которую мы получили в пункте 3. А вторая, вспомогательная (назовем ее Ме), будет нести гены, которые мы выкинули в пункте 1. Обе плазмиды начнут размножаться в хозяйской клетке. Плазмида Ме будет экспрессировать свои белки — например, белки оболочки и белки, необходимые для самосборки вирусов. Поскольку на Пу есть участки для налипания белков оболочки, то эти белки на нее и налипнут, и в результате мы получим вирус с необходимыми генами внутри, чего мы и добивались.
Итак, наш план действий таков:
- Подбираем какие-нибудь клетки, которые хорошо поддаются трансфекции (такая линия клеток называется «упаковывающей»; обычно это линия эмбриональных клеток человеческой почки НЕК293) и засовываем в них сразу две плазмиды — Пу и Ме, основную и вспомогательную;
- Ждем некоторое время (около двух дней), чтобы успели образоваться вирусы. После этого собираем среду, в которой живут клетки, — вирусы плавают в ней;
- Очищаем полученные вирусы (как правило, для этого используется центрифугирование и фильтрация) и.
- Используем их по назначению, то есть, заражаем ту линию клеток, на которой собираемся проводить эксперименты.
Это, конечно, только общая схема, у каждого конкретного вектора есть свои нюансы. Например, бывает, что вместо одной вспомогательной плазмиды используют две или даже три. При создании некоторых AAV-векторов упаковывающие клетки нужно заразить аденовирусом. А если мы создаем вектор для генной терапии, который должен уметь размножаться в хозяйской клетке и заражать ее соседей, то нам придется гораздо аккуратнее обращаться с вирусным геномом и расчищать в нем место с большой осторожностью, чтобы не нарушить способность вирусов к самостоятельному размножению. И так далее.
Последний шаг
Итак — ура! — тем или иным способом мы все-таки умудрились засунуть вектор в клетки. Нам остается последний шаг — нужно выбрать из всех клеток те, которые встроили векторную ДНК в свой геном.
Собственно, для этого мы и добавили в вектор последний селективный маркер — ген устойчивости к антибиотику, работающему на эукариотических клетках. Мы просто будем постоянно добавлять этот антибиотик в среду, в которой находятся наши клетки, — в результате останутся в живых и смогут делиться только те, которые имеют в геноме этот ген и всю нашу векторную ДНК впридачу.
Все! Клонирование завершено. Мы получили линию генетически модифицированных клеток, в геноме которых присутствует наша вставка. Пришло время проводить с этими клетками необходимые эксперименты.