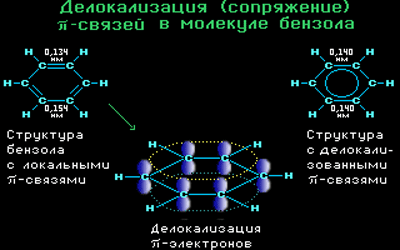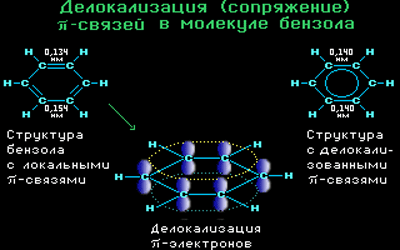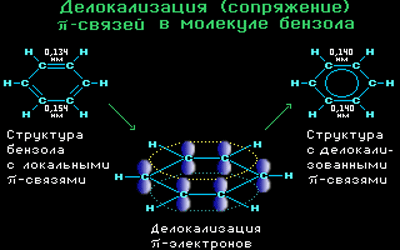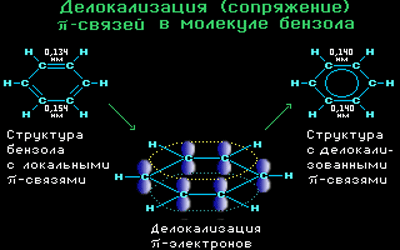
Современная теория строения молекулы бензола базируется на представлении о гибридизации орбиталей атома углерода.
Учебный фильм «Строение молекулы бензола»
Согласно этой теории, атомы углерода в бензоле находятся в состоянии sp 2 -гибридизации.
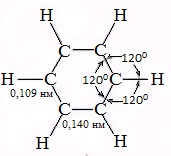
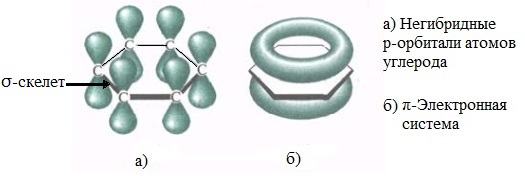
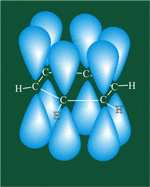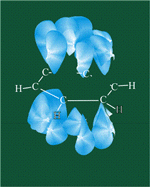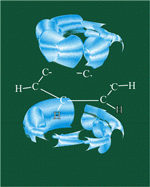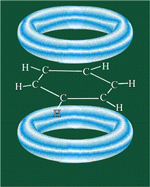
Каждый атом углерода образует три σ-связи (две с атомами углерода и одну – с атомом водорода). Валентные углы между каждой парой σ-связей равны 120°. Таким образом, все шесть атомов углерода и все σ-связи С-С и С-лежат в одной плоскости, образуя правильный шестиугольник (σ-скелет молекулы бензола).
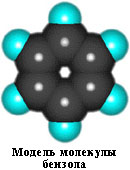
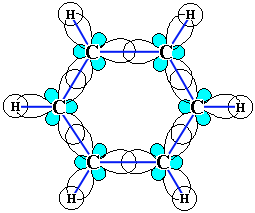
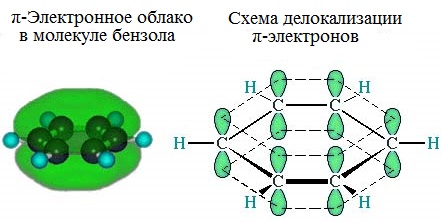
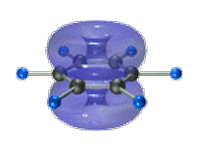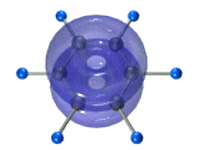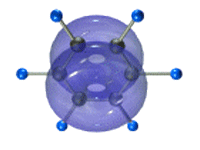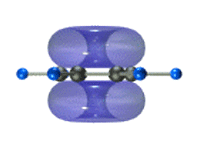
Каждый атом углерода имеет одну негибридную р-орбиталь. Шесть таких орбиталей располагаются перпендикулярно плоскому σ-скелету и параллельно друг другу. Все шесть р-электронов взаимодействуют между собой, образуя π-связи, не локализованные в пары, как при образовании обычных двойных связей, а образующие единое π-электронное облако и единую химическую связь для всех атомов углерода.
Таким образом, в молекуле бензола осуществляется круговое сопряжение, образуется единая сопряженная π-система. Наибольшая π-электронная плотность в этой сопряженной системе располагается над и под плоскостью σ-скелета.
Сочетание шести σ-связей с единой π-системой называется ароматической связью.
Цикл из шести атомов углерода, связанных ароматической связью, называется бензольным кольцом, или бензольным ядром.
π-Электронное облако обусловливает сокращение расстояния между атомами углерода.
Все связи С-С в бензоле равноценны, их длина равна 0,140 нм, что соответствует промежуточному значению между длиной простой связи (0,154 нм) и двойной (0,134 нм). Это означает, что в молекуле бензола нет чередования простых и двойных связей, а существует особая связь – «полуторная» – промежуточная между простой и двойной, так называемая ароматическая связь.
Поэтому структурную формулу бензола изображают в виде правильного шестиугольника (σ-скелет) с окружностью внутри, обозначающего делокализованные π-связи.
Такое электронное строение объясняет все особенности бензола. Становится понятно, почему бензол трудно вступает в реакции присоединения – это приводит к нарушению сопряжения. Такие реакции возможны только в очень жестких условиях.
Таким образом, наряду с формулой Кекуле используется формула бензола, где обобщенное электронное облако изображают замкнутой линией внутри кольца.
- Арены (ароматические углеводороды)
- Строение аренов
- Гомологический ряд аренов
- Номенклатура аренов
- Изомерия аренов
- Структурная изомерия
- Химические свойства аренов
- 1. Реакции присоединения
- 1.1. Гидрирование
- 1.2. Хлорирование аренов
- 2. Реакции замещения
- 2.1. Галогенирование
- 2.2. Нитрование
- 2.3. Алкилирование ароматических углеводородов
- 2.4. Сульфирование ароматических углеводородов
- 3. Окисление аренов
- 3.1. Полное окисление – горение
- 3.2. О кисление гомологов бензола
- 4. Ориентирующее действие заместителей в бензольном кольце
- 5. Особенности свойств стирола
- Получение аренов
- 1. Реакция Вюрца-Фиттига
- 2. Дегидроциклизация алканов
- 3. Дегидрирование циклоалканов
- 4. Декарбоксилирование солей бензойной кислоты
- 5. Алкилирование бензола и его гомологов
- 6. Тримеризация ацетилена
- 7. Получение стирола
- Бензол: общая формула углеводорода и гомологического ряда
- Формула бензола: какой из вариантов написания правильный?
- Строение бензола
- Бензол: формула, отражающая истинное строение
- Свойства бензольного кольца
- Как изобразить формулу бензола?
- ГЕКСАН С6Н14
- Ароматические углеводороды ряда бензола
- Гексан
- Электронное строение бензола
- Гомологический ряд, изомерия, номенклатура
- Физические свойства
- Химические свойства
- I. Реакции замещения
- II. Реакции присоединения
- III. Реакции окисления
- Свойства гомологов бензола
- I. Реакции с участием боковой цепи
- II. Реакции с участием бензольного ядра
- Способы получения бензола
- Способы получения гомологов бензола
- Ароматические углеводороды. Бензол, структурная формула, строение, свойства. Применение бензола и его гомологов.
- Бензол: формула. Бензол: электронное строение, свойства
Видео:6.1. Ароматические углеводороды (бензол и его гомологи): Строение, номенклатура, изомерияСкачать

Арены (ароматические углеводороды)
Арены (ароматические углеводороды) – это непредельные (ненасыщенные) циклические углеводороды, молекулы которых содержат устойчивые циклические группы атомов (бензольные ядра) с замкнутой системой сопряженных связей.
Общая формула: CnH2n–6 при n ≥ 6.
Видео:Бензол. Строение и свойства | Химия ЕГЭ для 10 класса | УмскулСкачать

Строение аренов
Рассмотрим подробно строение молекулы бензола. В ней присутствуют три двойные связи С=С, три одинарные связи С–C и шесть одинарных связей С–Н.
Структурная формула бензола:
Сокращенная структурная формула бензола:
Каждый из шести атомов углерода в молекуле бензола находится в состоянии sp 2 -гибридизации.
Каждый атом углерода в молекуле бензола связан с двумя соседними атомами углерода и атомом водорода тремя σ-связями. Валентные углы равны 120 0 :
| Атомы углерода и водорода в молекуле бензола, соединенные σ-связями, образуют правильный шестиугольник, в котором все атомы углерода и все σ-связи С–С и С–Н лежат в одной плоскости. |
| Негибридные р-орбитали атомов углерода образуют единую циклическую (ароматическую) π-систему – единое электронное облако над и под плоскостью кольца. |
Соответственно, на самом деле все связи между атомами углерода в молекуле бензола одинаковой длины (0,140 нм), что соответствует промежуточному значению между одинарной и двойной (полуторная связь).
Соответственно, в молекуле бензола между углеродными атомами нет обычных одинарных и двойных связей, а все они выравнены (делокализованы).
| Поэтому структурную формулу бензола изображают в виде правильного шестиугольника и кружка внутри него, который обозначает делокализованные π-связи: |
Видео:Как строить структурные формулы быстро, как ФЛЭШ — Мое полное РуководствоСкачать

Гомологический ряд аренов
Простейший представитель гомологического ряда аренов — бензол:
Ближайший гомолог бензола – толуол (метилбензол):
Еще один представитель гомологического ряда бензола – этилбензол:
Изопропилбензол (кумол):
Видео:Химия 10 класс (Урок№4 - Арены (ароматические углеводороды).)Скачать

Номенклатура аренов
Первый представитель гомологического ряда аренов — бензол:
Ближайший гомолог бензола – толуол (метилбензол):
При составлении названия ароматического соединения за главную цепь принимают молекулу бензола. Если в ароматическом кольце несколько заместителей, то атомы углерода бензольного кольца нумеруются: в направлении, где больше заместителей, от самого главного заместителя (чем больше атомов углерода в радикале, тем он старше).
| Например, 1,2-диметилбензол |
Если в молекуле бензола присутствуют два заместителя, то также используют систему специальных приставок:
- орто— (о-)если заместители расположены у соседних атомов углерода в бензольном кольце (1,2-положения);
- мета— (м-)заместители расположены через один атом углерода (1,3-положения);
- пара— (п-)заместители расположены на противоположных сторонах кольца (1,4-положения).
| 1,2-Диметилбензол | 1,3-Диметилбензол | 1,4-Диметилбензол |
 |  |  |
| орто-Диметилбензол | мета-Диметилбензол | пара-Диметилбензол |
Для названия многих производных бензола используют тривиальные названия:
| Структурная формула | Системное название | Тривиальное название |
 | Метилбензол | Толуол |
 | 1,2-Диметилбензол | орто-Ксилол |
 | Изопропилбензол | Кумол |
Названия радикалов, содержащих ароматическое кольцо:
| Фенил | Бензил |
 |  |
Видео:Составление формул органических соединений по названиюСкачать

Изомерия аренов
Видео:Химические свойства бензола и его гомологов. 1 часть. 11 класс.Скачать

Структурная изомерия
Для гомологов бензола характерна структурная изомерия .
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
- Изомерия углеродного скелета в боковой цепи характерна для ароматических углеводородов, которые содержат три и более атомов углерода в боковой цепи.
| Например. Формуле С9Н12 соответствуют изомеру изопропилбензол и пропилбензол |
| Изопропилбензол | Пропилбензол |
 |  |
- Изомерия положения заместителей характерна для аренов, которые содержат два и более заместителей в бензольном кольце.
| Например. Формуле С9Н12 соответствуют изомеру изопропилбензол и пропилбензол |
| Изопропилбензол | Пропилбензол |
 |  |
Видео:Ароматические углеводороды / Бензол / Изомерия и номенклатура ареновСкачать

Химические свойства аренов
Арены – непредельные углеводороды, молекулы которых содержат три двойных связи и цикл. Но из-за эффекта сопряжения свойства аренов отличаются от свойств других непредельных углеводородов.
Для ароматических углеводородов характерны реакции:
- присоединения,
- замещения,
- окисления (для гомологов бензола).
| Из-за наличия сопряженной π-электронной системы молекулы ароматических углеводородов вступают в реакции присоединения очень тяжело, только в жестких условиях — на свету или при сильном нагревании, как правило, по радикальному механизму |
| Бензольное кольцо представляет из себя скопление π-электронов, которое притягивает электрофилы. Поэтому для ароматических углеводородов характерны реакции электрофильного замещения атома водорода у бензольного кольца. |
Ароматическая система бензола устойчива к действию окислителей. Однако гомологи бензола окисляются под действием перманганата калия и других окислителей.
Видео:Структурные формулы (видео 22) | Химические связи и структура молекул | ХимияСкачать
1. Реакции присоединения
Бензол присоединяет хлор на свету и водород при нагревании в присутствии катализатора.
1.1. Гидрирование
Бензол присоединяет водород при нагревании и под давлением в присутствии металлических катализаторов (Ni, Pt и др.).
При гидрировании бензола образуется циклогексан:
При гидрировании гомологов образуются производные циклоалканы. При нагревании толуола с водородом под давлением и в присутствии катализатора образуется метилциклогексан:
1.2. Хлорирование аренов
Присоединение хлора к бензолу протекает по радикальному механизму при высокой температуре, под действием ультрафиолетового излучения.
При хлорировании бензола на свету образуется 1,2,3,4,5,6-гексахлорциклогексан (гексахлоран).
Гексахлоран – пестицид, использовался для борьбы с вредными насекомыми. В настоящее время использование гексахлорана запрещено.
Гомологи бензола не присоединяют хлор. Если гомолог бензола реагирует с хлором или бромом на свету или при высокой температуре (300°C), то происходит замещение атомов водорода в боковом алкильном заместителе, а не в ароматическом кольце.
| Например, при хлорировании толуола на свету образуется бензилхлорид |
| Если у гомолога бензола боковая цепь содержит несколько атомов углерода – замещение происходит у атома, ближайшему к бензольному кольцу («альфа-положение»). |
| Например, этилбензол реагирует с хлором на свету |
Видео:Молекулярные и эмпирические формулыСкачать
2. Реакции замещения
| Реакции замещения у ароматических углеводородов протекают по ионному механизму (электрофильное замещение). При этом атом водорода замещается на другую группу (галоген, нитро, алкил и др.). |
2.1. Галогенирование
Бензол и его гомологи вступают в реакции замещения с галогенами (хлор, бром) в присутствии катализаторов (AlCl3, FeBr3).
При взаимодействии с хлором на катализаторе AlCl3 образуется хлорбензол:
Ароматические углеводороды взаимодействуют с бромом при нагревании и в присутствии катализатора – FeBr3 . Также в качестве катализатора можно использовать металлическое железо.
Бром реагирует с железом с образованием бромида железа (III), который катализирует процесс бромирования бензола:
| Гомологи бензола содержат алкильные заместители, которые обладают электронодонорным эффектом: из-за того, что электроотрицательность водорода меньше, чем углерода, электронная плотность связи С-Н смещена к углероду. На нём возникает избыток электронной плотности, который далее передается на бензольное кольцо. |
| Поэтому гомологи бензола легче вступают в реакции замещения в бензольном кольце. При этом гомологи бензола вступают в реакции замещения преимущественно в орто— и пара-положения |
| Например, при взаимодействии толуола с хлором образуется смесь продуктов, которая преимущественно состоит из орто-хлортолуола и пара-хлортолуола |
Мета-хлортолуол образуется в незначительном количестве.
При взаимодействии гомологов бензола с галогенами на свету или при высокой температуре (300 о С) происходит замещение водорода не в бензольном кольце, а в боковом углеводородном радикале.
| Если у гомолога бензола боковая цепь содержит несколько атомов углерода – замещение происходит у атома, ближайшему к бензольному кольцу («альфа-положение»). |
Например, при хлорировании этилбензола:
2.2. Нитрование
Бензол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты (нитрующая смесь).
При этом образуется нитробензол:
| Серная кислота способствует образованию электрофила NO2 + : |
Толуол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты.
В продуктах реакции мы указываем либо о-нитротолуол:
Нитрование толуола может протекать и с замещением трех атомов водорода. При этом образуется 2,4,6-тринитротолуол (тротил, тол):
2.3. Алкилирование ароматических углеводородов
- Арены взаимодействуют с галогеналканами в присутствии катализаторов (AlCl3, FeBr3 и др.) с образованием гомологов бензола.
| Например, бензол реагирует с хлорэтаном с образованием этилбензола |
- Ароматические углеводороды взаимодействуют с алкенами в присутствии хлорида алюминия, бромида железа (III), фосфорной кислоты и др.
| Например, бензол реагирует с этиленом с образованием этилбензола |
| Например, бензол реагирует с пропиленом с образованием изопропилбензола (кумола) |
- Алкилирование спиртами протекает в присутствии концентрированной серной кислоты.
| Например, бензол реагирует с этанолом с образованием этилбензола и воды |
2.4. Сульфирование ароматических углеводородов
Бензол реагирует при нагревании с концентрированной серной кислотой или раствором SO3 в серной кислоте (олеум) с образованием бензолсульфокислоты:
Видео:Ароматические углеводородыСкачать

3. Окисление аренов
Бензол устойчив к действию даже сильных окислителей. Но гомологи бензола окисляются под действием сильных окислителей. Бензол и его гомологи горят.
3.1. Полное окисление – горение
При горении бензола и его гомологов образуются углекислый газ и вода. Реакция горения аренов сопровождается выделением большого количества теплоты.
Уравнение сгорания аренов в общем виде:
При горении ароматических углеводородов в недостатке кислорода может образоваться угарный газ СО или сажа С.
Бензол и его гомологи горят на воздухе коптящим пламенем. Бензол и его гомологи образуют с воздухом и кислородом взрывоопасные смеси.
3.2. О кисление гомологов бензола
Гомологи бензола легко окисляются перманганатом и дихроматом калия в кислой или нейтральной среде при нагревании.
При этом происходит окисление всех связей у атома углерода, соседнего с бензольным кольцом, кроме связи этого атома углерода с бензольным кольцом.
Толуол окисляется перманганатом калия в серной кислоте с образованием бензойной кислоты:
Если окисление толуола идёт в нейтральном растворе при нагревании, то образуется соль бензойной кислоты – бензоат калия:
Таким образом, толуол обесцвечивает подкисленный раствор перманганата калия при нагревании.
| При окислении других гомологов бензола всегда остаётся только один атом С в виде карбоксильной группы (одной или нескольких, если заместителей несколько), а все остальные атомы углерода радикала окисляются до углекислого газа или карбоновой кислоты. |
| Например, при окислении этилбензола перманганатом калия в серной кислоте образуются бензойная кислота и углекислый газ |
| Например, при окислении этилбензола перманганатом калия в нейтральной кислоте образуются соль бензойной кислоты и карбонат |
Более длинные радикалы окисляются до бензойной кислоты и карбоновой кислоты:
При окислении пропилбензола образуются бензойная и уксусная кислоты:
Изопропилбензол окисляется перманганатом калия в кислой среде до бензойной кислоты и углекислого газа:
Видео:Химия. 9 класс. Ароматические углеводороды. Бензол /23.04.2021/Скачать

4. Ориентирующее действие заместителей в бензольном кольце
Если в бензольном кольце имеются заместители, не только алкильные, но и содержащие другие атомы (гидроксил, аминогруппа, нитрогруппа и т.п.), то реакции замещения атомов водорода в ароматической системе протекают строго определенным образом, в соответствии с характером влияния заместителя на ароматическую π-систему.
| Заместители подразделяют на две группы в зависимости от их влияния на электронную плотность ароматической системы: электронодонорные (первого рода) и электроноакцепторные (второго рода). |
Типы заместителей в бензольном кольце
| Заместители первого рода | Заместители второго рода |
| Дальнейшее замещение происходит преимущественно в орто— и пара-положение | Дальнейшее замещение происходит преимущественно в мета-положение |
| Электронодонорные, повышают электронную плотность в бензольном кольце | Электроноакцепторные, снижают электронную плотность в сопряженной системе. |
|
|
| Например, толуол реагирует с хлором в присутствии катализатора с образованием смеси продуктов, в которой преимущественно содержатся орто-хлортолуол и пара-хлортолуол. Метильный радикал — заместитель первого рода. |
В уравнении реакции в качестве продукта записывается либо орто-хлортолуол, либо пара-хлортолуол.
| Например, при бромировании нитробензола в присутствии катализатора преимущественно образуется мета-бромтолуол. Нитро-группа — заместитель второго рода |

Видео:ВАЛЕНТНОСТЬ. Графические формулы веществ | Химия | TutorOnlineСкачать

5. Особенности свойств стирола
Стирол (винилбензол, фенилэтилен) – это производное бензола, которое имеет в своем составе двойную связь в боковом заместителе.
Общая формула гомологического ряда стирола: CnH2n-8.
| Молекула стирола содержит заместитель с кратной связью у бензольного кольца, поэтому стирол проявляет все свойства, характерные для алкенов – вступает в реакции присоединения, окисления, полимеризации. |
Стирол присоединяет водород, кислород, галогены, галогеноводороды и воду в соответствии с правилом Марковникова.
| Например, при гидратации стирола образуется спирт: |
| Стирол присоединяет бром при обычных условиях, то есть обесцвечивает бромную воду |
При полимеризации стирола образуется полистирол:
Как и алкены, стирол окисляется водным раствором перманганата калия при обычных условиях. Обесцвечивание водного раствора перманганата калия — качественная реакция на стирол:
При жестком окислении стирола перманганатом калия в кислой среде (серная кислота) разрывается двойная связь и образуется бензойная кислота и углекислый газ:
При окислении стирола перманганатом калия в нейтральной среде при нагревании также разрывается двойная связь и образуется соль бензойной кислоты и карбонат:
Видео:Строение молекулы бензолаСкачать
Получение аренов
Видео:6.3. Ароматические углеводороды (бензол и его гомологи): Химические свойства. ЕГЭ по химииСкачать

1. Реакция Вюрца-Фиттига
Хлорбензол реагирует с хлорметаном и натрием. При этом образуется смесь продуктов, одним из которых является толуол:
Видео:Строение молекулы бензола. 11 класс.Скачать
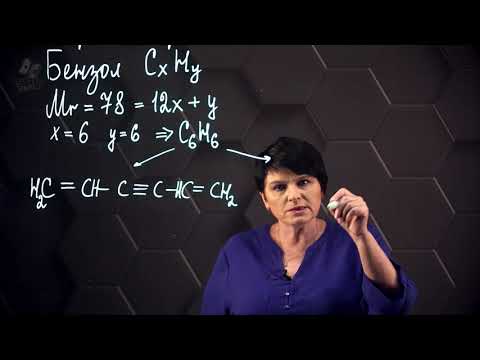
2. Дегидроциклизация алканов
Алканы с углеродной цепью, содержащей 6 и более атомов углерода в главной цепи, при дегидрировании образуют устойчивые шестиатомные циклы, т. е. циклогексан и его гомологи, которые далее превращаются в ароматические углеводороды.
Гексан при нагревании в присутствии оксида хрома (III) в зависимости от условий может образовать циклогексан и потом бензол:
Гептан при дегидрировании в присутствии катализатора образует метилциклогексан и далее толуол:
Видео:1. Алканы. Структурные формулы, названия, гомологи, радикалыСкачать

3. Дегидрирование циклоалканов
При дегидрировании циклогексана и его гомологов при нагревании в присутствии катализатора образуется бензол или соответствующие гомологи бензола.
| Например, при нагревании циклогексана в присутствии палладия образуется бензол и водород |
| Например, при нагревании метилциклогексана в присутствии палладия образуется толуол и водород |
Видео:КАК ДАВАТЬ НАЗВАНИЯ органическим соединениям | КАК СОСТАВЛЯТЬ ФОРМУЛЫ в органической химииСкачать

4. Декарбоксилирование солей бензойной кислоты
Реакция Дюма — это взаимодействие солей карбоновых кислот с щелочами при сплавлении.
R–COONa + NaOH → R–H + Na2CO3
Декарбоксилирование — это отщепление (элиминирование) молекулы углекислого газа из карбоксильной группы (-COOH) или органической кислоты или карбоксилатной группы (-COOMe) соли органической кислоты.
Взаимодействие бензоата натрия с гидроксидом натрия в расплаве протекает аналогично реакции получения алканов по реакции Дюма с образованием бензола и карбоната натрия:
Видео:Углеводороды. Тема 17. Ароматические углеводороды. Бензол, строение молекулыСкачать

5. Алкилирование бензола и его гомологов
- Арены взаимодействуют с галогеналканами в присутствии катализаторов (AlCl3, FeBr3 и др.) с образованием гомологов бензола.
| Например, бензол реагирует с хлорэтаном с образованием этилбензола |
- Ароматические углеводороды взаимодействуют с алкенами в присутствии хлорида алюминия, бромида железа (III), фосфорной кислоты и др.
| Например, бензол реагирует с этиленом с образованием этилбензола |
| Например, бензол реагирует с пропиленом с образованием изопропилбензола (кумола) |
- Алкилирование спиртами протекает в присутствии концентрированной серной кислоты.
| Например, бензол реагирует с этанолом с образованием этилбензола и воды |
Видео:Упражнения на составление формул и названий гомологов и изомеров | Химия 10 класс #5 | ИнфоурокСкачать

6. Тримеризация ацетилена
При нагревании ацетилена под давлением над активированным углем молекулы ацетилена соединяются, образуя бензол.
При тримеризации пропина образуется 1,3,5-триметилбензол.
Видео:Структурные формулы вещества. Правила построения структурных формул.Скачать

7. Получение стирола
Стирол можно получить дегидрированием этилбензола:
Стирол можно также получить действием спиртового раствора щелочи на продукт галогенирования этилбензола (1-хлор-1-фенилэтан):
Бензол: общая формула углеводорода и гомологического ряда
Формула бензола: какой из вариантов написания правильный?
Ароматические углеводороды имеют циклическое строение. Первый представитель этого ряда – бензол (C6H6).
Формулу, отражающую строение вещества, впервые предложил химик Кекуле в 1865 году.
По рассказам ученого, он долго размышлял над загадкой бензола. Однажды ночью ему приснился змей, укусивший себя за хвост.
Утром структурная формула бензола уже была составлена. Она представляла собой кольцо, состоящее из 6 углеродных атомов. Три из них были при двойной связи.
Строение бензола
Углерод в составе ароматических углеводородов образует правильный шестиугольник. Иногда при записи уравнений реакций его изображают вытянутым в вертикальном направлении.
Эта группа атомов получила специальное название – бензольное ядро. Подтверждением циклического строения бензола является его получение из трех молекул ацетилена – непредельного углеводорода с тройной связью.
Ароматические углеводороды тоже являются непредельными и проявляют некоторые свойства, характерные для алкенов. По этой причине в бензольном кольце тремя черточками, идущими параллельно граням, отмечают наличие двойной связи. Такая формула бензола не в полной мере отражает состояние углеродных атомов в молекуле.
Бензол: формула, отражающая истинное строение
В реальности связи между углеродом в кольце равноценны между собой. Среди них не удалось выделить одинарные и двойные. Объясняется такая особенность электронным строением бензола, при котором углерод в ядре находится в sp2-гибридизованном состоянии, соединен с соседями по кольцу и водородом тремя обычными одинарными связями.
В этом случае возникает шестиугольник, в котором находятся в одной плоскости 6 атомов углерода и 6 — водорода. Только электронные облака четвертых p-электронов, не участвующих в гибридизации, расположены иначе. Их форма напоминает гантели, центр приходится на плоскость кольца.
А утолщенные части находятся сверху и снизу. В таком случае над бензольным ядром и под ним расположены две электронные плотности, возникшие при перекрывании облаков p-электронов. Возникает общая химическая связь для углерода в кольце.
Свойства бензольного кольца
За счет общей электронной плотности сокращаются расстояния между углеродом в кольце. Они равны 0,14 нм. Если бы в ядре бензола существовали одинарные и двойные связи, то было бы два показателя: 0,134 и 0,154 нм.
Истинная структурная формула бензола не должна содержать простых и двойных связей. Поэтому ароматические углероды причисляют к непредельным органическим соединениям лишь формально. По составу они напоминают алкены, но могут вступать в реакции замещения, что характерно для предельных углеводородов.
Ароматическое ядро бензола обладает значительной устойчивостью к окислителям. Все перечисленные особенности позволяют считать кольцо особым типом связи — не двойной и не одинарной.
Как изобразить формулу бензола?
Правильной является формула бензола не с тремя двойными связями, как у Кекуле, а в виде шестиугольника с кружком внутри. Он символизирует общую принадлежность 6 электронов.
Находит подтверждение симметрия строения и в свойствах вещества. Кольцо бензола является устойчивым, имеет значительную энергию сопряжения.
Свойства первого представителя ароматических углеводородов проявляются у его гомологов. Каждый из них может быть представлен как производное, в котором происходит замещение водорода на различные углеводородные радикалы.
ГЕКСАН С6Н14
мол. м. 86,18. Г. и его изомеры — бесцв. жидкости (см. табл.); хорошо раств. в орг. р-рителях, не раств. в воде.
Ароматические углеводороды ряда бензола
Обладают всеми хим. св-вами, характерными для насыщенных углеводородов. н-Г. содержится в бензиновых фракциях нефтей и газовых конденсатов. При риформинге этих фракций (преим. прямогонных) он изомеризуется в изогексаны и дегидроциклизуется в бензол.
В составе пентан-гексановой или гексановой фракции бензина н-Г. изомеризуется в изогексаны при 100-450
- ГЕКСАН, C6H14 — бесцветная горючая жидкость, tкип 68,74шC, t пл -95,32шC.Содержится в нефтепродуктах; при их переработке превращается в бензол; при изомеризации образует изогексан — высокооктановый компонент моторных топлив…
- Гексан — н-гексан, насыщенный углеводород C6H14; бесцветная жидкость; tkип 69 °С, плотность 0,660 г/см3 , показатель преломления п20D 1,37506… Большая Советская энциклопедия
- ГЕКСАН — СН34-СН3, бесцветная жидкость, tкип 68,74 .С. Содержится в нефтепродуктах; при их химической переработке превращается в бензол; при изомеризации образует изогексан — высокооктановый компонент моторных топлив…Большой энциклопедический словарь
- гексан — … Орфографический словарь русского языка
- гексан — гекс'… Русский орфографический словарь
- гексан — сущ., кол-во синонимов: 4 • алкан • жидкость • парафин • углеводород…
Гексан
Из книги Большая Советская Энциклопедия (ГЕ) автора БСЭ
Понятие «бензольное кольцо» сразу требует расшифровки. Для этого необходимо хотя бы коротко рассмотреть строение молекулы бензола. Первая структура бензола была предложена в 1865 г. немецким ученым А. Кекуле:
К наиболее важным ароматическим углеводородам относятся бензол С6Н6 и его гомологи : толуол С6Н5СНз, ксилол С6Н4(СНз)2 и др.; нафталин C10H8, антрацен С14Н10 и их производные.
Атомы углерода в молекуле бензола образуют правильный плоский шестиугольник, хотя обычно его рисуют вытянутым.
Окончательно строение молекулы бензола подтверждено реакцией образования его из ацетилена. В структурной формуле изображается по три одинарных и три двойных чередующихся углерод-углеродных связей. Но такое изображение не передает истинного строения молекулы. В действительности углерод-углеродные связи в бензоле равноценны, и они обладают свойствами, не похожими на свойства ни одинарных, ни двойных связей.
Эти особенности объясняются электронным строением молекулы бензола.
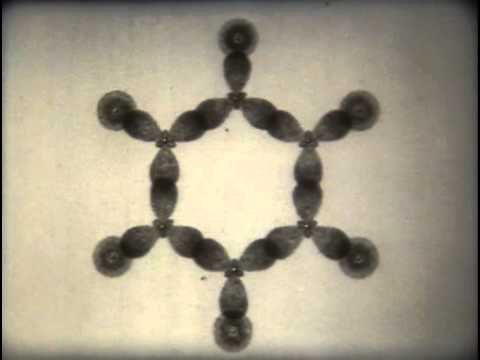
Электронное строение бензола
Каждый атом углерода в молекуле бензола находится в состоянии sp2-гибридизации. Он связан с двумя соседними атомами углерода и атомом водорода тремя σ-связями.
В результате образуется плоский шестиугольник: все шесть атомов углерода и все σ-связи С-С и С-Н лежат в одной плоскости.
Электронное облако четвертого электрона (р-электрона), не участвующего в гибридизации, имеет форму гантели и ориентировано перпендикулярно к плоскости бензольного кольца.
Такие р-электронные облака соседних атомов углерода перекрываются над и под плоскостью кольца.
В результате шесть р-электронов образуют общее электронное облако и единую химическую связь для всех атомов углерода.
Две области большой электронной плоскости расположены по обе стороны плоскости σ-связей.
p-Электронное облако обусловливает сокращение расстояния между атомами углерода.
В молекуле бензола они одинаковы и равны 0,14 нм. В случае простой и двойной связи эти расстояния составили бы соответственно 0,154 и 0,134 нм. Значит, в молекуле бензола нет простых и двойных связей. Молекула бензола — устойчивый шестичленный цикл из одинаковых СН-групп, лежащих в одной плоскости.
Все связи между атомами углерода в бензоле равноценны, чем и обусловлены характерные свойства бензольного ядра. Наиболее точно это отражает структурная формула бензола в виде правильного шестиугольника с окружностью внутри (I). (Окружность символизирует равноценность связей между атомами углерода.) Однако часто пользуются и формулой Кекуле с указанием двойных связей (II):
Бензольное ядро обладает определенной совокупностью свойств, которую принято называть
Гомологический ряд, изомерия, номенклатура
Условно арены можно разделить на два ряда.
К первому относят производные бензола (например, толуол или дифенил), ко второму — конденсированные (полиядерные) арены (простейший из них — нафталин):
Гомологический ряд бензола имеет общую формулу СnН2n-6.
Гомологи можно рассматривать как производные бензола, в котором один или несколько атомов водорода замещены различными углеводородными радикалами. Например, С6Н5-СН3 — метилбензол или толуол, С6Н4(СН3)2 — диметилбензол или ксилол, С6Н5—С2Н5 — этилбензол и т.д.
Так как в бензоле все углеродные атомы равноценны, то у первого его гомолога — толуола — изомеры отсутствуют.
У второго гомолога — диметилбензола — имеются три изомера, отличающиеся взаимным расположением метильных групп (заместителей). Это орто- (сокращенно о-), или 1,2-изомер, в нем заместители находятся у соседних атомов углерода.
Если заместители разделены одним атомом углерода, то это мета- (сокращенно м-) или 1,3-изомер, а если они разделены двумя атомами углерода, то это пара- (сокращенно п-) или 1,4-изомер. В названиях заместители обозначаются буквами (о-, м-, п-) или цифрами.
Физические свойства
Первые члены гомологического ряда бензола — бесцветные жидкости со специфическим запахом.
Плотность их меньше 1 (легче воды). В воде нерастворимы. Бензол и его гомологи сами являются хорошими растворителями для многих органических веществ. Арены горят коптящим пламенем ввиду высокого содержания углерода в их молекулах.
Химические свойства
Ароматичность определяет химические свойства бензола и его гомологов. Шестиэлектронная π-система является более устойчивой, чем обычные двухэлектронные π-связи.
Поэтому реакции присоединения менее характерны для ароматических углеводородов, чем для непредельных углеводородов. Наиболее характерными для аренов являются реакции замещения. Таким образом, ароматические углеводороды по своим химическим свойствам занимают промежуточное положение между предельными и непредельными углеводородами.
I. Реакции замещения
1. Галогенирование (с Cl2, Вr2)
4. Алкилирование (образуются гомологи бензола) — реакции Фриделя-Крафтса
Алкилирование бензола происходит также при его взаимодействии с алкенами:
Дегидрированием этилбензола получают стирол (винилбензол):
II. Реакции присоединения
III. Реакции окисления
2С6Н6 + 15O2 → 12СO2 + 6Н2O
2. Окисление под действием КМnO4, К2Сr2O7, HNO3 и др.
Не происходит химической реакции (сходство с алканами).
Свойства гомологов бензола
В гомологах бензола различают ядро и боковую цепь (алкильные радикалы).
По химическим свойствам алкильные радикалы подобны алканам; влияние бензольного ядра на них проявляется в том, что в реакциях замещения всегда участвуют атомы водорода у атома углерода, непосредственно связанного с бензольным ядром, а также в более легкой окисляемости С-Н связей.
Влияние электронодонорного алкильного радикала (например, -СН3) на бензольное ядро проявляется в повышении эффективных отрицательных зарядов на атомах углерода в орто- и пара-положениях; в результате облегчается замещение связанных с ними атомов водорода.
Поэтому гомологи бензола могут образовывать тризамещенные продукты (а бензол обычно образует монозамещенные производные).
I. Реакции с участием боковой цепи
2. Окисление под действием КМnO4, HNO3 и др.
II. Реакции с участием бензольного ядра
При избытке галогена:
Способы получения бензола
1. Сплавление солей бензойной кислоты с щелочами
2. Дегидрирование циклогексана
3. Дегидроциклизация гексана
4. Тримеризация ацетилена
Способы получения гомологов бензола
1. Алкилирование бензола по Фриделю — Крафтсу
2. Конденсация арилгалогенидов с алкилгалогенидами — реакция Вюрца — Фиттига
3. Ароматизация алканов
4. Каталитическая дегидрогенизация гомологов циклогексана
Кроме одноядерных ароматических углеводородов, к которым относятся бензол и его гомологи, существуют также многоядерные арены; например:
Ароматические углеводороды. Бензол, структурная формула, строение, свойства. Применение бензола и его гомологов.

Имеют общую формулу СnH2n-6. Особенностью аренов является наличие бензольного кольца и ароматической связи.
Тип sp2-гибридизации, негибридные электроны образуют единую π-систему (ароматическую связь). Эту систему изображают в формуле в виде кольца.
Бензол- это бесцветная жидкость со специфическим запахом. В воде не растворим. Сам бензол является хорошим растворителем для многих органических веществ.
Горит коптящим пламенем, так как содержит большое количество углерода в молекуле. Получить бензол можно тримеризацией ацитилена:
2.Добавка к бензину
3.Производство органических соединений
Основные положения теории химического строения органических веществ А.М.Бутлерова. Химическое строение как порядок соединения и взаимного влияния атомов в молекуле.
В своей теории Александр Михайлович Бутлеров обобщил опыт и знания ученых органиков того времени и объяснил строение молекул органических веществ. Это теория играет важную роль в объяснении строения и свойств всех органических веществ.
Основные положения теории химического строения веществ А.М.
- Атомы в органический молекулах реально существуют. Доказательством служит получение искусственным путем органический веществ из неорганических.
- Соединения атомов в молекулах веществ происходит в определенной последовательности их валентности.
- Свойства вещества зависят от строения их молекул.
- По свойствам вещества можно определить его строение, а по строению — свойства.
- Атомы и группы атомов взаимно влияют друг на друга.
Изомерия органических веществ, ее виды.
Изомерия- это явление существование разных веществ- изомеров, имеющих одинаковый состав, но разные свойства и строение.
Различают два основных вида изомерии:
- Структурная (различный порядок связей между атомами в молекуле)
- Пространственная (расположение атомов в пространстве при одинаковом порядке связей между ними)
Структурная изомерия подразделяется на несколько разновидностей.
Изомерия углеродного скелета.
Бензол: формула. Бензол: электронное строение, свойства
Различный порядок связи между атомами углерода, образующими скелет молекулы.
- Изомерия положения.Группа атомов определяют принадлежность соединений к тому или иному классу органических соединений. Изомерия непредельных соединений может быть вызвана различным положением кратной связи, как, например, в бутене-1 и бутене-2:
Межклассовая изомерия – вещества одного состава могут принадлежать к разным классам органических соединений:
алкены изомерны циклоалканам
предельные одноатомные спирты – простым эфирам
карбоновые кислоты – сложным эфирам
Пространственная изомерия подразделяется на два вида:
- Геометрическая изомерия (свойственна соединениям, содержащим двойные связи (С = С, C = N и др.).
Заместители могут быть расположены либо по одну сторону плоскости двойной связи (цис-положение) либо по разные стороны (транс-положение)).
- Оптическая изомерия (свойственна молекулам органических веществ, не имеющим плоскости симметрии и не совмещающимся со своим зеркальным отображением)
Природные источники углеводородов: газ, нефть, каменный уголь.
Их переработка и практическое применение.
Основными природными источниками углеводородов являются нефть, природный газ и каменный уголь.
Природный газ.
Природный газ – смесь газов, основным компонентом которой является метан, остальное приходится на долю этана, пропана, бутана, и небольшого количества примесей – азота, оксида углерода (IV), сероводорода и паров воды.
90% его расходуют в качестве топлива, остальные 10% используют как сырье для химической промышленности: получение водорода, этилена, ацетилена, сажи, различный пластмасс, медикаментов и др.
Нефть
Нефть – маслянистая жидкость от желтого или светло-бурого до черного цвета с характерным запахом. Она легче воды и в ней практически нерастворима. Нефть представляет собой смесь примерно 150 углеводородов с примесями других веществ, поэтому у нее нет определенной температуры кипения.
90% добываемой нефти используется как сырье для производства различных видов топлива и смазочных материалов.
В то же время нефть – ценное сырье для химической промышленности.
Нефть, добываемую из земных недр, называю сырой. В сыром виде нефть не применяют, ее подвергают переработке.
Нефть – сырье для производства не только топлива, но и многих органических веществ.
Каменный уголь.
Каменный уголь так же является источником энергии и ценным химическим сырьем.
В составе каменного угля в основном органические вещества, а также вода, минеральные вещества, при сжигании образующие золу.
Одним из видов переработки каменного угля является коксование – это процесс нагревания угля до температуры 1000°С без доступа воздуха. Коксование угля проводят в коксовых печах. Кокс состоит из практически чистого углерода. Его используют в качестве восстановителя при доменом производстве чугуна на металлургических заводах.
Он используется как бытовое, энергетическое топливо, сырье для металлургической и химической промышленности, а также для извлечения из него редких элементов.