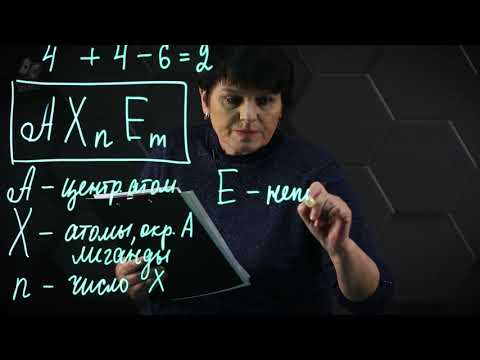Ученым IBM Research удалось синтезировать треугольную молекулу, которая считалась невозможной в традиционной химии. С ее помощью физики смогут создавать долгожданные квантовые компьютеры.
Читайте «Хайтек» в
Молекула называется триангулен и выглядит похожей на графен, двухмерный слой углерода с атомами, расположенными шестиугольником. Атомы углерода в каждом углу треугольной молекулы соединены с атомами водорода. Важно то, что молекула содержит два свободных электрона, именно поэтому ее так сложно было создать — электроны стремятся создавать пары, поэтому молекулы со свободными электронами высокореактивны и оттого нестабильны.
Лео Гросс и его команда ученых из швейцарского центра IBM Research подошли к созданию молекулы не стандартным для химии путем — вместо химических реакций они использовали атомно-силовой микроскоп, созданный ими в 2009 году.
В Сингапуре принят план создания экономики будущего
Для создания триангулена ученые использовали молекулу-прототип с двумя лишними атомами водорода на том месте, где у триангулена должны быть свободные электроны. Разместив ее под микроскопом, они использовали монооксид углерода и золотой наконечник, чтобы ее изучить, а затем двумя точными разрядами отделили атомы водорода, оставив два свободных электрона. Триангулен оставался стабилен в течение четырех дней.
«Триангулен оказался первой молекулой, которую не смогли создать химики, а нам это удалось», — заявил Гросс в интервью изданию Nature.
Этот эксперимент, помимо торжества физики над химией, имеет и практическое значение: когда ученые протестировали магнитные свойства молекулы, они подтвердили, что два свободных электрона обладают одинаковыми спинами, и ими можно управлять. Такие молекулы могут найти применение в создании квантовых компьютеров, пишет Quartz.
LibreTaxi — революция в сфере пассажирских перевозок
Новую молекулярную структуру, способную нейтрализовать ядерные отходы и химические вещества, изобрели ученые Университета Индианы. Существование такой «супермолекулы» с двумя отрицательно заряженными ионами ранее считалось невозможным.
Видео:Гибридизация и геометрические формы молекул доступным языком. (Общая химия)Скачать

Методическая разработка урока по обобщению и систематизации знаний на тему «Геометрия молекул»
Разделы: Химия
Цель урока: обобщить и систематизировать знания учащихся о зависимости пространственной конфигурации молекул от типа гибридизации атомных орбиталей; совершенствовать умения определять геометрию различных частиц, используя модель гибридизации атомных орбиталей Л. Полинга.
Оборудование: набор моделей атомов для составления молекул,
модели различных многогранников.
Межпредметные связи: геометрия.
Ход урока.
I. Мобилизующее начало урока.
1. Постановка познавательных задач.
2. Актуализация знаний.
Беседа:
1) Какие свойства ковалентной связи вам известны?
2) Какое свойство ковалентной связи определяет пространственную конфигурацию (геометрию) частиц?
Для описания пространственного строения молекул удобнее всего пользоваться моделью гибридизации атомных орбиталей, предложенной американским ученым Л. Полингом.
3) Что такое гибридизация атомных орбиталей?
4) Какие типы гибридизации вам известны?
II. Обобщение и систематизация знаний учащихся.
1. Задания для самостоятельной работы: Рассмотрите пространственную конфигурацию частиц:
1. Фторид бериллия – BeF2.
Рисунок 1. Электронное строение молекулы фторида бериллия.
2. Хлорид бора – BCl3.
Рисунок 2. Электронное строение молекулы хлорида бора
3. Метан – CH4.
Рисунок 3. Электронное строение молекулы метана
4. Аммиак – NH3.
Рисунок 4. Электронное строение молекулы аммиака
sp 3 -гибридизация АО; 3 σ-связи
Молекула NH3 имеет форму правильной пирамиды, валентный угол – 107 0 3΄.
5. Вода – H2O.
Рисунок 5. Электронное строение молекулы воды
sp 3 -гибридизация АО; 3 σ-связи
Молекула H2O – угловая, валентный угол – 104 0 5΄.
6. Этилен – C2H4.
Рисунок 6. Электронное строение молекулы этилена
2. Совершенствование умений определять тип гибридизации атомных орбиталей и геометрию частиц.
Задача. Для определения структуры молекул в газовой фазе иногда используют метод электронографии, который позволяет найти межъядерные расстояния в молекуле по интенсивности упругого рассеяния электронов. По экспериментальным данным межъядерные расстояния в молекуле NCl3 оказались равны r(N-C1) = 0,176 нм, r(С1-С1) = 0,283 нм. Установите, какую геометрическую фигуру образуют ядра атомов в этой молекуле. Какой тип гибридизации центрального атома позволяет описать данное строение молекулы?
Решение: Все три связи N-C1 в молекуле NC13 одинаковы. Молекула может иметь форму правильного треугольника, если атом азота находится в плоскости, образованной тремя атомами хлора:
Рисунок 7. Электронное строение молекулы хлорида азота
III. Подведение итогов урока. Домашнее задание.
1. Рассмотрите пространственную конфигурацию частиц SF6, BF3, С2Н2.
2. Решите задачу: по данным электронографического эксперимента межъядерные расстояния в молекуле ВI3 равны: г(В-I) = 0,210 нм. Определите, какую геометрическую фигуру образуют ядра атомов в этой молекуле. Установите тип гибридизации центрального атома.
Литература
1. Герус С. А. Изучение теории химической связи на заключительном этапе обобщения знаний// Химия: методика преподавания. – 2003. – №7. – с. 27 – 36.
2. Ахметов Н.С. Актуальные вопросы курса неорганической химии: Кн. для учителя. – М.: Просвещение, 1991. – 224 с.
3. Кузнецова Н.Е. Формирование систем понятий в обучении химии. – М.: просвещение, 1989. – 144 с.
4. Кузьменко Н.Е., Еремин В. В., Попков В. А. Начала химии. Современный курс для поступающих в вузы. – М.: «Экзамен», 2000. – 720с.
5. Чертков И.Н. Изучение строения и свойств органических веществ. Метод, пособие для учителей. – М.: Просвещение, 1972. – 190 с.
Видео:Гибридизация атомных орбиталей и геометрия молекул. 10 класс.Скачать

Молекула имеет форму треугольника
В главе 11 мы узнали, что для получения замкнутой электронной конфигурации атом C нуждается в образовании четырёх связей, для атома N требуется три связи, а для атома O — две связи. Если это будут связи с водородом, то получится метан, аммиак и вода: CH4, NH3 и H2O. При обсуждении молекулы HF в конце главы 13 мы отметили, что некоторые электроны атома F совершенно не были вовлечены в образование связей. Эти электроны находятся в спаренном состоянии, по сути, на атомных орбиталях, и называются неподелёнными парами. Неподелённые пары — это пары несвязывающих электронов, которые вызывают повышение электронной плотности в той области пространства, которую они занимают. Электроны, образующие связи, избегают располагаться вблизи неподелённых пар. Поэтому хотя неподелённые пары не являются связями, они также влияют на форму молекул. В связях электроны используются совместно и в основном концентрируются где-то между двумя атомами. Неподелённые пары не тянутся ко второму атому. Как следствие, их электронные облака расположены вблизи атомов, которым они принадлежат, и по размерам они больше, чем облака пар, образующих связи.
На рис. 14.2 изображены модели молекул метана, аммиака и воды. У аммиака имеется одна неподелённая пара, а у воды — две. Если принять в расчёт неподелённые пары, то все три молекулы имеют в своей основе тетраэдрическую форму. Однако аммиак и вода представляют собой неправильные тетраэдры. Неподелённая пара аммиака больше по размеру, чем связывающие пары. Чтобы минимизировать общее электрон-электронное отталкивание и достичь наименьшей энергии, связи удаляются от неподелённых пар, а значит, сближаются между собой. Угол HNH в молекуле аммиака составляет 107,3° — чуть меньше, чем в правильном тетраэдре. У воды две неподелённые пары, и поэтому угол между водород-кислородными связями уменьшается ещё сильнее — до 104,5°.
Рис. 14.2. Метан (слева), аммиак (посередине) и вода (справа). Неподелённые пары электронов отталкивают связывающие пары электронов, заставляя связи сближаться, из-за чего уменьшаются углы между связями атомов H с центральным атомом
Молекулы треугольной формы
Если центральный атом связан только с тремя другими атомами, молекула будет иметь прямоугольную форму с четырьмя атомами, лежащими в одной плоскости. На рис. 14.3 изображены две треугольные молекулы: BH3 и H2CO (формальдегид). Молекула BH3 существует, но она химически очень активна, поскольку ей не хватает двух электронов до замкнутой конфигурации оболочки, как у неона. В BH3 каждый атом H имеет одиночную связь с B. Угол HBH равен в точности 120°. Атомы водорода образуют идеальный равносторонний треугольник. При такой форме молекулы связи оказываются максимально удалёнными друг от друга, что снижает энергию за счёт уменьшения отталкивания между связывающими электронами каждой связи.
В главе 13 на диаграмме МО для O2 (см. рис. 13.8) показано, что молекула кислорода имеет двойную связь. В формальдегиде (пахучей жидкости, которой заполняют банки с биологическими образцами в кабинетах биологии) атом O имеет двойную связь с атомом C. Эта двойная связь показана на шаростержневой модели двумя цилиндрами, соединяющими атомы, вместо одного. Двойная связь обеспечивает атому O замкнутую неоновую конфигурацию оболочки, как в молекуле О2. Атом C нуждается в двух дополнительных электронах, чтобы получить замкнутую неоновую конфигурацию оболочки, и он получает их за счёт одиночных связей с двумя атомами H. Мы ещё обсудим подробно двойные связи, чтобы разобраться, как они могут образовываться из атомных орбиталей, но сейчас нам нужно лишь понять, что двойная связь концентрирует две пары электронов между атомами C и O. Из-за этой дополнительной электронной плотности двойная связь становится шире одиночной. Более толстая двойная связь C=O расталкивает одиночные связи C−H, заставляя их сближаться друг с другом. Все углы обозначены на рис. 14.3. В результате молекула формальдегида, оставаясь плоской треугольной, отклоняется от формы равностороннего треугольника.
Рис. 14.3. Слева: молекула BH 3 . Атомы лежат в одной плоскости. Связи HB являются одинарными, атомы водорода образуют равносторонний треугольник. Все углы HBH равны 120°. Справа: молекула H 2 CO (формальдегид). Атомы лежат в одной плоскости. Связь CO — двойная. Углы не равны
Переходящие электроны
Возвращаясь к метану, зададимся вопросом: каким образом он формирует четыре связи в тетраэдрической конфигурации? В главе 11 обсуждались электронные конфигурации атомов (см. рис. 11.1). Углерод имеет шесть электронов: два на 1s-орбитали, два на 2s-орбитали и два на 2p-орбитали. Валентные электроны, то есть участвующие в образовании химических связей, — это 2s- и 2p-электроны. В верхней части рис. 14.4 показаны энергетические уровни атомных орбиталей с заполняющими их четырьмя валентными электронами. 1s-электроны не показаны.
Рис. 14.4. Вверху: атомные валентные орбитали электрона с четырьмя валентными электронами. Внизу: при образовании химических связей атом углерода «повышает» 2s-электрон до уровня 2p, чтобы получить четыре неспаренных электрона для образования четырёх связей с другими атомами
Как отмечалось в главе 11 и ранее в этой главе, углерод образует четыре связи. В метане он создаёт четыре электронные пары, совместно используемые с четырьмя атомами водорода. Каждый атом H вкладывает один электрон. Поэтому углерод должен иметь четыре неспаренных электрона для образования этих связей. Каждый неспаренный электрон углерода может объединиться с одним электроном водорода и образовать связывающую пару электронов. Чтобы иметь четыре неспаренных электрона, углерод «поднимает» 2s-электрон на 2p-орбиталь, как это показано в нижней части рис. 14.4. У изолированного атома углерода такая конфигурация не возникает, если только не передать ему значительное количество энергии. Для атома углерода перемещение 2s-электрона на 2p-орбиталь — это переход к конфигурации с повышенной
📺 Видео
Как отличать полярные молекулы от неполярных? Дипольный момент.Скачать

Органическая Химия — ЭТО НУЖНО ВИДЕТЬ! Гибридизация орбиталейСкачать

Типы гибридизации атома углерода | Химия ЕГЭ 10 класс | УмскулСкачать

Химия 11 класс (Урок№3 - Пространственное строение молекул.)Скачать

Геометрия МолекулСкачать

Что Такое Фракталы? Простое Объяснение!Скачать

Алкены. Строение, гибридизация, углы, геометрическая форма молекулСкачать

Строение молекул ч. 1Скачать

Кому и зачем нужна геометрия? | Определяем строение молекулыСкачать

опровержение первого видео ЗЕМЛЯ ТРЕУГОЛЬНАЯ ШОКСкачать

Пространственное строение молекулСкачать

Как за 4 МИНУТЫ выучить Химию? Химическое Количество, Моль и Закон АвогадроСкачать

Гибридизация. Полярные и неполярные молекулы. Самоподготовка к ЕГЭ и ЦТ по химииСкачать

Урок 11 (осн). Атомы и молекулыСкачать

Опыты по химии. Шаростержневые модели молекулСкачать

Как строить структурные формулы быстро, как ФЛЭШ — Мое полное РуководствоСкачать

Метод ВССкачать

Теория отталкивания электронных пар. Метод Гиллеспи. 1 часть. 10 класс.Скачать