На третьем курсе на занятиях по физической химии мы изучали различные диаграммы состояния. Особо запомнились своим довольно необычным видом такие диаграммы при постоянных температуре и давлении для систем, состоящих из трёх веществ, так как изображались они в виде равностороннего треугольника (т. н. «треугольник Гиббса-Розебома»), где каждая его точка соответствовала смеси какого-либо определённого состава (рис. 1, 2), а концентрации выражались как доли компонентов.
Рис. 1. Трёхкомпонентная система уксусная кислота – хлороформ – вода при комнатной температуре [1, с. 338].
Рис. 2. Диаграмма растворимости KCl и NaCl в воде при 298 К [2, с. 485].
Также на лекциях нам рассказывали про два правила, по одному из которых каждой точке треугольника-диаграммы ставился в соответствие состав трёхкомпонентной смеси. Опишу кратко эти правила [3, с. 229] на примере системы из веществ A, B и C, мольные доли которых составляют x , y и z соответственно. Рассмотрим точку D внутри равностороннего треугольника △ABC (рис. 3). Какому соотношению x : y : z она соответствует?
Рис. 3. Определение состава смеси по правилам Гиббса и Розебома.
1) По правилу Гиббса высота треугольника принимается за единицу (или за 100%) и используется тот факт, что сумма длин перпендикуляров, опущенных из точки D на стороны треугольника равна его высоте. В этом случае концентрации (доли) компонентов пропорциональны длинам этих перпендикуляров:
x : y : z = DA’ : DB’ : DC’
2) По правилу Розебома за единицу (за 100%) принимается длина стороны треугольника, при этом из точки D проводятся отрезки, параллельные каждой из его сторон (на рис. 3 это DA», DB», DC»). Сумма их длин равна стороне треугольника и выполняется следующее соотношение:
x : y : z = DA» : DB» : DC»
или в иной записи
Легко видеть, что правила Гиббса и Розебома нисколько не противоречат друг другу:
x : y : z = DA’ : DB’ : DC’ = DA» : DB» : DC»
Это обусловлено тем, что △DA’A», △DB’B» и △DC’C» являются подобными (как треугольники с равными углами: ∠DA’A» = ∠DB’B» = ∠DC’C» = 90°; а ∠DA»A’ = ∠DB»B’ = ∠DC»C’ = 60°, поскольку DA» || AB, DB» || BC, DC» || AC).
Простого запоминания описанных правил вполне хватило для подготовки к сдаче экзамена, тем более дальнейшая жизнь сложилась так, что за все последующие годы с диаграммами состояния мне иметь дело особо-то и не доводилось. Тем не менее в те времена появилось ощущение, что что-то в этих правилах определения состава системы меня смущает и спустя год я понял, что же именно. Дело было в следующем. Очевидно, что доли компонентов системы связаны между собой соотношением
однако из такого равенства неизбежно следует, что для графического изображения множества точек, координаты которых удовлетворяют такому равенству, необходимо использовать трёхмерное пространство, потому что переменных в уравнении три, но при этом треугольник Гиббса-Розебома – это именно треугольник, то есть плоская (двумерная) фигура. Почему так? В итоге до меня дошла очень простая вещь: если переписать (3) как
то получается известное из аналитической геометрии «уравнение плоскости в отрезках», которое в общем виде записывается так:
где l , m и n – точки, в которых данная плоскость пересекает оси абсцисс, ординат и аппликат соответственно. Отсюда получается, что треугольник Гиббса-Розебома располагается именно в плоскости, описываемой уравнением (4). Можно сказать иначе: поскольку каждая из величин x , y , z принимает значения от 0 до 1 (потому что это доли компонентов в смеси), то треугольник Гиббса-Розебома является расположенным в первом октанте графиком функции
Из этого факта как раз и следует, что для построения диаграммы состояния трёхкомпонентной системы вполне достаточно плоского изображения. А ещё любопытно здесь другое. Взгляните на рис. 4 – на нём изображён треугольник Гиббса-Розебома в «трёхмерном» представлении.
Рис. 4. Треугольник Гиббса-Розебома, представленный как график функции z = 1 – x – y .
В △ABC выбрана точка D, от которой к сторонам этого треугольника проведены перпендикуляры DA’, DB’, DC’. Сама точка D имеет координаты ( a , b , c ), численные значения которых являются концентрациями входящих в состав смеси компонентов. Вершины △ABC с точкой начала координат образуют тетраэдр и из симметрии данного геометрического тела следует, что двугранные углы, образованные плоскостью △ABC и координатными плоскостями, равны. При этом в соответствии с теоремой, обратной теореме о трёх перпендикулярах , получается, что A’A» ⊥ BC, B’B» ⊥ AC, C’C» ⊥ AB, следовательно ∠DA’A», ∠DB’B» и ∠DC’C» являются линейными углами соответствующих двугранных углов, и значит они равны между собой. Отсюда вытекает, что △DA’A», △DB’B» и △DC’C» – подобные, из чего напрямую получается соотношение для правила Гиббса, аналогичное (1):
В связи с этим мне в голову уже давно закралась следующая мысль: а может создатели диаграмм состояния, когда разрабатывали способы наглядного преставления характеристик трёхкомпонентых систем, руководствовались схожими соображениями – про уравнение плоскости «в отрезках», про получающиеся при этом подобные треугольники и т. д.? Не удивлюсь, если такое действительно было опубликовано тем же самым Дж.У. Гиббсом в своих научных работах, а теперь, спустя более века и став классикой, успело подзабыться. В учебниках по физической химии, на которые я выше ссылался, и в ряде других [5, с. 422; ; 7, с. 401], сведений, подтверждающих приведённые догадки, нет – такую информацию нужно искать специально, но сначала необходимо суметь заставить себя заняться подобными поисками.
Кстати, схожая ситуация наблюдается и в отношении «правила креста» – очень легко отыскать литературу и сайты, где подробно рассказывается как решать задачи на смешение растворов с использованием этого правила, а вот материала, в котором описано откуда именно это правило берётся (то есть его математическое обоснование), мне обнаружить не удалось – пришлось восполнять этот пробел самостоятельно написанием соответствующей заметки.
- Эткинс П. Физическая химия. Том 1. М.: Мир, 1980. – 586 с.
- Физическая химия. В 2 кн. Кн. 1. Строение вещества. Термодинамика. Учеб. для вузов / Под ред. К.С. Краснова – 3-е изд., испр. – М.: Высшая школа, 2001. – 512 с.
- Карякин Н.В. Основы химической термодинамики: Учеб. пособие для вузов. Нижний Новгород: Издательство ННГУ им. Н.И. Лобачевского; М.: Издательский центр «Академия», 2003. – 464 с.
- Геометрия: Учеб. для 10-11 кл. сред. шк. / Л.С. Аганасян, В.Ф. Бутузов, С.Б. Кадомцев и др. – М.: Просвещение, 1992. – 207 с.
- Курс физической химии, том 1 / Под ред. Я.И. Герасимова. М.: Химия. 1964. – 624 с.
- Карапетьянц М.Х. Химическая термодинамика: Учебное пособие. Изд. 4-е. М.: Книжный дом «ЛИБРОКОМ», 2013. – 584 с.
- Киреев В.А. Курс физической химии. Изд. 3-е, перераб. и доп. М.: Химия, 1976. – 775 с.
Видео:Свободная энергия Гиббса. 10 класс.Скачать

Метод Гиббса и Розебома.
Фазовые диаграммы трехкомпонентных систем.
Добавление третьего компонента к бинарной системе всегда влияет на взаимную растворимость данных двух компонентов. При этом критическая температура бинарной системы может возрастать или уменьшаться, т.е. взаимная растворимость первых двух компонентов может улучшаться или ухудшаться. Это зависит от способности третьего компонента растворяться в первых двух. Допустим , что компоненты А и Б ограниченно смешиваются. Если третий компонент С в равной степени растворим в компонентах А и Б, то взаимная смешиваемость компонентов А и Б улучшается., ВКТР понижается и НКТР повышается. Если третий компонент растворим в компоненте А значительно лучше чем в компоненте Б (или наоборот), то взаимная растворимость А и Б ухудшается, ВКТР повышается, а НКТР понижается. Проиллюстрируем это следующим примером. Система фенол-вода обладает ВКТР, равной 338К. Добавление 1% нафталина, который растворяется в феноле и не растворяется воде, приводит к повышению ВКТР до 353 К; добавление 1% олеата натрия, хорошо растворимого и в воде и в феноле, понижает Tc до 316К.
Аналогичная картина наблюдается при добавлении неорганических солей и кислот к двум ограниченно смешивающимся жидкостям А и Б. Если электролит хорошо растворим в обеих жидкостях, то при его добавлении их взаимная растворимость улучшается; если только в одной из них — то ухудшается. Так, электролиты NaCl, KCl, MgSO4 и др., хорошо растворимые в воде и не растворимые в феноле, вызывают сильное повышение критической температуры и искажение бинодали, связанное с тем, что система уже не является строго бинарной. При большом количестве добавленного электролита, не растворимого в одном из компонентов бинарной смеси, может произойти ее расслоение даже в том случае, если компоненты полностью смешивались. Это явление получило название высаливания. Если электролит растворим в обеих ограниченно смешивающихся жидкостях, то его добавление вызывает улучшение их взаимной растворимости, что обозначается термином 
всаливание.
Явление высаливания очень подробно изучено для водных растворов белков, а для низкомолекулярных жидкостей имеющиеся в литературе данные были обобщены Блешинским, который трехкомпонентные системы жидкость-жидкость-электролит представил в виде диаграмм, одной осью которых является концентрация электролита (рис. 1). Из рисунка следует возможность различных случаев:
Две жидкости при данной температуре смешиваются неограниченно. Добавление электролита вызывает высаливание и расслаивание системы (рис. 1а).
Две жидкости при данной температуре смешиваются ограниченно, добавление электролита улучшает их взаимное смешение, и при некотором количестве добавленного электролита жидкости начинают смешиваться неограниченно (всаливание) (рис. 1б).
Добавление первых количеств электролита может вызвать улучшение взаимной растворимости жидкостей. (рис 1в) или ухудшение (рис 1г).
Фазовые диаграммы трехкомпонентных систем при постоянной температуре обычно выражают в виде равностороннего треугольника, вершины которого отвечают 100% каждого компонента, а точки, лежащие на его сторонах — составам бинарных систем. Любая точка, лежащая внутри треугольника, отражает состав трехкомпонентной системы. Для построение таких диаграмм требуется любым методом определить состав трехкомпонентной системы, при котором она расслаивается. Часто для этой цели используют метод точек помутнения, т.е. при заданной температуре фиксируют количество третьего компонента, вызывающего помутнение бинарной смеси заданного состава. Затем строят диаграмму по методам Розебома или Гиббса.
Метод Гиббса и Розебома.
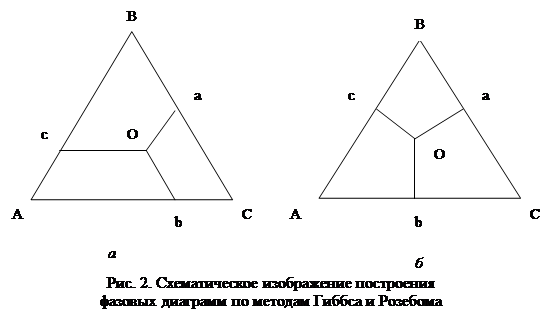 |
В методе Розебома за единицу принимается сторона равностороннего треугольника, на который откладывают мольные доли трех компонентов в расслаивающейся системе (рис. 2а). Через точки M и N проводят линии параллельные сторонам треугольника до пересечения их в точке О. Отрезок Оа, т.е. линия, соединяющая точку О со стороной, лежащей против угла А, отвечающего 100% данного компонента, равна его содержанию в трехкомпонентном растворе. Аналогично этому, отрезок Оb отвечает содержанию компонента Б и отрезок Ос — содержанию компонента С.
В методе Гиббса за единицу принимается высота треугольника и состав смеси выражают линиями, перпендикулярными сторонам треугольника, соединяющими точки внутри его со сторонами, лежащими против углов, отвечающих 100% данного компонента (рис. 2б).
Видео:Метод РозебомаСкачать

Построение диаграмм состояния трехкомпонентных систем
Состав двухкомпонентной системы можно было представить точкой на оси составов, а любое свойство системы откладывать на оси ординат и тем самым получать плоские диаграммы (так мы поступали ранее). Состав трехкомпонентной системы можно передать точкой на плоскости, а любое свойство системы (Р, Гит. п.) откладывать по оси аппликат, таким образом, диаграммы трехкомпонентных систем объемные, они изображаются в трехмерном пространстве.
Сначала научимся выражать состав трехкомпонентной системы на плоскости. Пусть система состоит из компонентов А, В и С, их молярные доли в сумме должны составлять единицу: ХА + Хв + Хс = 1. Следовательно, мы должны построить такую диаграмму, которая автоматически гарантировала бы выполнение этого условия. Как впервые показал Гиббс, требуемое свойство имеет равносторонний треугольник. Из элементарной геометрии известно, что сумма расстояний от любой точки до трех сторон равна высоте треугольника [1] . На рис. 4.30 это проиллюстрировано для равностороннего треугольника с высотой 1. Если молярные доли ХА, Хв и Хс изобразить тремя расстояниями по вертикали до сторон треугольника, то смесь любого состава можно представить в виде точки внутри треугольника.
Сторона АВ соответствует Хс = 0, то же справедливо для двух других сторон. Таким образом, три стороны треугольника соответствуют трем бинарным системам (А, В), (В, С) и (С, А). Стороны треугольника делят на 100 (или 10) частей и через точки деления проводят прямые, параллельные соответствующим сторонам.
Представим треугольник (рис. 4.30), размеченный такими линиями, тогда высота над основанием представляет собой молярную долю компонента, указанного у противоположной вершины. Так, на рисунке точка Р соответствует молярным долям компонентов: ХА = 0,50, = 0,10, Хс = 0,4.
Рис. 4.30. Представление состава трехкомпонентной системы в виде треугольника Гиббса
Важное свойство треугольной диаграммы заключается в смысле прямой линии, связывающей вершину с точкой на противоположной стороне (см. рис. 4.30). Любая точка на указанной линии соответствует составу с постепенным возрастанием количества А при переходе от Р’ через Р к Р», но смысл состоит в том, что В и С остаются в той же начальной пропорции. Это обусловлено свойствами подобных треугольников. Поэтому, если мы хотим представить изменение состава системы при добавлении в нее компонента А, необходимо лишь провести линию из вершины А в точку на ВС, соответствующую составу начальной бинарной системы. Любая тройная система, образующаяся при добавлении А, будет соответствовать некоторой точке на этой линии.
Приведем и другие закономерности, связанные с представлением состава на треугольной диаграмме:
- 1) при движении точки, характеризующей состав системы, в сторону от вершины треугольника концентрация компонента, соответствующего этой вершине, уменьшается. Например, движение по линии АР’Р» в направлении к основанию треугольника означает уменьшение содержания компонента А;
- 2) любая прямая, параллельная стороне треугольника, противоположной данной вершине, представляет собой линию постоянной концентрации компонента, которому эта вершина соответствует.
Перпендикуляры к плоскости треугольника образуют координату любого свойства системы — температуры плавления или кипения, давления пара, плотности, поверхностного натяжения и т. п. Таким образом, трехмерная диаграмма, например, «состав — температура», представляется в виде прямой трехгранной призмы, основанием которой служит равносторонний треугольник состава, а ее высотой — ось, на которой откладываются значения температуры, давления и т. п.
📽️ Видео
Треугольник Гиббса. Изучение взаимной растворимости в жидкой трехкомпонентной системе.Скачать

ОФХиТК. Семинар от 24.12.2020Скачать

Закон Гесса. 10 класс.Скачать

09 Фаз диагр двухкомп сист 1 принципы и мех смесьСкачать
Физхимия 11 лекцияСкачать

Треугольник Гиббса. 2 часть. Задача. Метод РозебомаСкачать

Свободная энергия Гиббса и самопроизвольные реакции (видео 8) | Энергия| БиологияСкачать

Фазовые диаграммы. Тройная точка. Критическое состояние вещества. 10 класс.Скачать

Фазовые диаграммыСкачать

09 Фазовые диаграммы 2 правило фазСкачать

Сферический избыток треугольникаСкачать

Миникурс по геометрии. ТреугольникиСкачать

ДИАГРАММА СОСТОЯНИЯ ЖЕЛЕЗО-ЦЕМЕНТИТ, железо-углерод, Fe+Fe3CСкачать
Лекция «Диаграмма состояния двухкомпонентных сплавов»Скачать

Энтропия. 10 класс.Скачать

Как построить равнобедренный или равносторонний треугольник по клеткам.Скачать